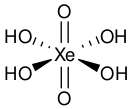
Ксеноновая кислота
| Ксеноновая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Тетрагидрокси(диоксо)ксенон | ||
| Хим. формула | H4XeO6 | ||
| Физические свойства | |||
| Молярная масса | 231,32 г/моль | ||
| Классификация | |||
| SMILES | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Ксеноновая кислота — очень неустойчивое химическое соединение с формулой H4XeO6. Очень сильная четырёхосновная кислота. Соли ксеноновой кислоты называются перксенаты, они, в отличие от самой кислоты, устойчивы.
Получение
Ксеноновую кислоту получают растворением оксида ксенона (VIII) в воде.
- [math]\ce{ {XeO4}+{2H2O} -> H4XeO6 }[/math]
Химические свойства
Не выделена в чистом виде, так как в кислотной среде быстро разлагается на триоксид ксенона и кислород[1][2]:
- [math]\ce{ {2HXeO6^{3-}} + {6H+} -> {2XeO3} + {4H2O} + {O2}\uparrow }[/math]
Её предполагаемая формула, H4XeO6, основана на октаэдральной геометрии перксенат-иона (XeO64−) в её солях щелочных металлов[1][3].
Было подсчитано, что pKa ксеноновой кислоты ниже нуля, что делает её очень сильной. Ксеноновая кислота ступенчато диссоциирует на ионы:
- [math]\ce{ H4XeO6 <=> {H+} + {H3XeO6^-} }[/math]
- [math]\ce{ {H+} + {H3XeO6^-} <=> {2H+} + {H2XeO6^{2-}} }[/math]
- [math]\ce{ {2H+} + {H2XeO6^{2-}} <=> {3H+} + {HXeO6^{3-}} }[/math]
- [math]\ce{ {3H+} + {HXeO6^{3-}} <=> {4H+} + {XeO6^{4-}} }[/math]
При этом ион H3XeO6− имеет относительно кислотное значение pKa 4,29, а ион H2XeO62− — 10,81[4]. Обычно образуются соли-перксенаты с анионом XeO64−[1][5].
Кислота является очень сильным окислителем благодаря иону XeO64−, в котором благородный газ окислен до максимальной степени окисления, отдав все 8 электронов с последней электронной оболочки.
См. также
Примечания
- ↑ Перейти обратно: 1,0 1,1 1,2 Klaening, U. K.; Appelman, E. H. Protolytic properties of perxenic acid (неопр.) // Inorganic Chemistry. — 1988. — Октябрь (т. 27, № 21). — С. 3760—3762. — doi:10.1021/ic00294a018.
- ↑ Holleman, Arnold Frederik & Wiberg, Egon (2001), Wiberg, Nils, ed., Inorganic Chemistry, San Diego/Berlin: Academic Press/De Gruyter, с. 400, ISBN 0-12-352651-5
- ↑ Hamilton; Ibers, J.; MacKenzie, D. Geometry of the Perxenate Ion (англ.) // Science. — 1963. — August (vol. 141, no. 3580). — P. 532—534. — ISSN 0036-8075. — doi:10.1126/science.141.3580.532. — . — PMID 17738629.
- ↑ John H. Holloway; Eric G. Hope. Advances in Inorganic Chemistry (неопр.) / A. G. Sykes. — Academic Press, 1998. — Т. 46. — С. 67. — ISBN 0-12-023646-X.
- ↑ Holleman, Arnold Frederik & Wiberg, Egon (2001), Wiberg, Nils, ed., Inorganic Chemistry, San Diego/Berlin: Academic Press/De Gruyter, с. 399, ISBN 0-12-352651-5