Ротавирусы
| Ротавирусы | |
|---|---|
 Компьютерная реконструкция ротавируса, основанная на нескольких микрографах | |
| Научная классификация | |
|
Реалм: Царство: Тип: Класс: Resentoviricetes Порядок: Reovirales Семейство: Подсемейство: Род: Ротавирусы |
|
| Международное научное название | |
| Rotavirus | |
| Виды[2] | |
|
|
| Группа по Балтимору | |
| III: дцРНК-вирусы | |
Ротавирусы[3] (лат. Rotavirus) — род вирусов с двунитевой сегментированной РНК, принадлежащий к семейству реовирусов (Reoviridae), возбудители ротавирусной инфекции.
Внешний вид частиц напоминает «колесо с широкой ступицей, короткими спицами и чётко очерченным ободком»[4], из-за чего они и получили своё название (от лат. rota — «колесо»).
Виды
Известно 9 видов данного рода, обозначаемых латинскими буквами A—J[2]. Человек может инфицироваться видами A, B и C, при этом возбудителем более 90 % ротавирусных инфекций является наиболее часто встречаемый вид — ротавирус A. Виды с A по D могут вызывать болезни у других животных[5]. К виду Ротавирус A относится несколько серотипов[6]. Как и в случае с вирусом гриппа, здесь применяется двойная классификация по подтипам поверхностных белков: серотипы G определяются вариациями гликопротеина VP7, а серотипы P — протеазочувствительным белком VP4[7]. Поскольку гены, определяющие G- и P-типы, наследуются независимо друг от друга, встречаются различные их комбинации[8].
Структура
Геном ротавируса состоит из 11 уникальных двунитевых молекул РНК, состоящих в общей сложности из 18 555 нуклеотидов. Нити нумеруются от 1 до 11 в порядке уменьшения длины, каждая представляет собой один ген. Каждый ген кодирует один белок, за исключением гена 9, кодирующего два белка[9]. РНК окружена трёхслойным белковым капсидом в форме усечённого икосаэдра. Каждый из слоёв сложен отдельным вирусным белком. Внутренний и средний слои перфорированы каналами. Средний слой визуально содержит «спицы колеса» (белок VP6) и является важнейшим компонентом вириона.[10] Размер вируса — 76,5 нм в диаметре[11][12], суперкапсида нет[5].
Белки
Вирион сформирован шестью структурными вирусными протеинами (VP), которые обозначаются как VP1, VP2, VP3, VP4, VP6 и VP7. Инфицированная вирусом клетка продуцирует также шесть неструктурных белков (NSP), не являющихся частью вирусной частицы. Они обозначаются: NSP1, NSP2, NSP3, NSP4, NSP5 и NSP6.
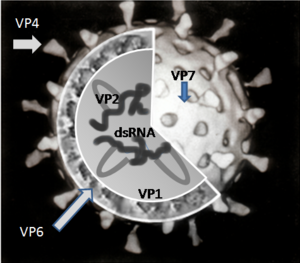
По крайней мере шесть из двенадцати кодируемых геномом вируса белков связываются с РНК[13]. Роль этих белков в репликации вируса до конца не выяснена; их функции, как считается, относятся к синтезу РНК и его упаковке в вирион, транспортировке мРНК к месту репликации, трансляции мРНК и регуляции экспрессии генов[14].
Структурные белки
VP1 располагается в ядре вирусной частицы и представляет собой фермент — РНК-полимеразу[15]. В инфицированной клетке фермент осуществляет синтез мРНК для дальнейшего производства вирусных белков, а также синтез сегментов РНК вирусного генома для новых вирионов.
VP2 формирует ядро вируса и связывает вирусный геном[16].
VP3 также составляет ядро вириона и является ферментом гуанилил-трансферазой. Данный фермент катализирует образование 5'-кэп во время процессинга пре-мРНК[17]. Кэп стабилизирует вирусную мРНК, защищая её от утилизации нуклеазами[18].
VP4 расположен на поверхности вириона и выступает с неё в виде шипа[19]. Он связывается с рецепторами на поверхности клеток и управляет внедрением вируса в клетку[20]. Для того, чтобы вирус смог вызывать инфекцию, VP4 должен быть модифицирован находящимся в кишечнике ферментом трипсином в VP5* и VP8*[21]. Именно VP4 определяет вирулентность вируса. VP4 используется для серотипической классификации ротавирусов наряду с VP7.
VP6 формирует толщу капсида. Этот белок крайне антигенен и может использоваться для определения вида ротавируса[22]. Этот белок используется для определения инфекции, вызванной ротавирусом А, в лабораторных тестах[23].
VP7 — структурный гликопротеин, формирующий наружную поверхность вириона. Он определяет G-тип серологической классификации и вместе с VP4 участвует в формировании иммунитета к инфекции[11].
Неструктурные белки
NSP1, продукт гена 5, является неструктурным РНК-связывающим белком[24]. NSP1 также блокирует продукцию интерферона, части врождённой иммунной системы, защищающей клетки от вирусной инфекции. NSP1 вынуждает протеасомы к лизису ключевых сигнальных компонентов, необходимых для стимуляции продукции интерферона в заражённой клетке и для реакции на интерферон, секретируемый соседними клетками. Целями для протеолитической деградации становятся несколько регуляторных факторов интерферона.[25]
NSP2 — РНК-связывающий белок, аккумулируется в цитоплазматических включениях (вироплазмах) и участвует в репликации генома[26][27].
NSP3 связывается с вирусной мРНК в заражённых клетках и отвечает за выключение синтеза клеточных белков[28]. NSP3 инактивирует два фактора инициации трансляции, необходимые для синтеза белков из мРНК клетки-хозяина. Во-первых, NSP3 выталкивает поли(а)-связывающий белок (PABP) из фактора инициации трансляции eIF4F. PABP необходим для эффективной трансляции транскриптов с 3'-хвостами, которые обнаруживаются у большинства транскриптов клетки-хозяина. Во-вторых, NSP3 инактивирует eIF2, стимулируя его фосфорилирование. В то же время эффективная трансляция вирусной мРНК не требует двух этих факторов, поскольку эта РНК не содержит 3'-концов.[29]
NSP4 — вирусный энтеротоксин, вызывающий диарею. Является первым обнаруженным вирусным энтеротоксином[30].
NSP5 кодируется сегментом 11 генома ротавируса А и в инфицированных вирусом клетках накапливается в вироплазмах[31].
NSP6 является белком, связывающим нуклеиновые кислоты[32], кодируется геном 11 по внефазовой открытой рамке считывания[33].
| Сегмент РНК (Ген) | Размер, спаренных оснований | Белок | Молекулярная масса, kDa | Положение | Копий на частицу | Функция |
|---|---|---|---|---|---|---|
| 1 | 3302 | VP1 | 125 | В вершинах ядра | <25 | РНК-зависимая РНК-полимераза |
| 2 | 2690 | VP2 | 102 | Формирует внутреннюю оболочку ядра | 120 | Стимулирует вирусную РНК-репликазу |
| 3 | 2591 | VP3 | 88 | В вершинах ядра | <25 | метилтрансфераза, мРНК-кэпирующий фермент |
| 4 | 2362 | VP4 | 87 | Шипы на поверхности капсида | 120 | Прикрепление к клетке, вирулентность |
| 5 | 1611 | NSP1 | 59 | Неструктурный белок | 0 | Связывание 5’РНК, блокирование продукции интерферона |
| 6 | 1356 | VP6 | 45 | Толща капсида (средний слой) | 780 | Структурная функция; видоспецифичный антиген |
| 7 | 1104 | NSP3 | 37 | Неструктурный белок | 0 | Усиливает активность вирусной мРНК, выключает синтез клеточных белков |
| 8 | 1059 | NSP2 | 35 | Неструктурный белок | 0 | НТФаза, участвует в упаковке РНК |
| 9 | 1062 | VP71 VP72 | 38 и 34 | На поверхности | 780 | Структурный белок; нейтрализирующий антиген |
| 10 | 751 | NSP4 | 20 | Неструктурный белок | 0 | Энтеротоксин |
| 11 | 667 | NSP5 NSP6 | 22 | Неструктурный белок | 0 | оцРНК- и дцРНК-связывающий модулятор активности NSP2, фосфопротеин |
Таблица составлена на основе штамма обезьяньего ротавируса SA11[34][35][36]. Размеры генов у некоторых других штаммов могут отличаться.
Репликация

Ротавирусы реплицируются главным образом в кишечнике[37] и заражают энтероциты ворсинок тонкого кишечника, что приводит к структурным и функциональным изменениям эпителия[38]. Тройная белковая оболочка делает их устойчивыми к кислой среде желудка и пищеварительным ферментам в кишечнике.
Существует два возможных пути проникновения вируса в клетку: прямая пенетрация через клеточную мембрану и эндоцитоз. Предполагается, что трансмембранное проникновение опосредовано гидрофобной областью VP5, являющегося продуктом расщепления VP4. Эта область закрыта у нерасщеплённого VP4, поэтому вирионы с белковыми шипами, не подвергшимися расщеплению, не способны проникнуть в клетку этим способом. Второй путь проникновения — эндоцитоз. Вирус проникает в клетку путём опосредованного рецепторами эндоцитоза и образует везикулы, известные как эндосомы. Белки в третьем слое (VP7 и шип VP4) нарушают мембрану эндосомы, создав разницу в концентрации кальция. Это вызывает распад VP7-тримеров на одиночные белковые субъединицы, при этом оставшиеся вокруг вирусной двунитевой РНК белки VP2 и VP6 образуют двухслойную частицу (DLP)[39].
Одиннадцать дцРНК-нитей остаются под защитой двух белковых оболочек, где вирусная РНК-зависимая РНК-полимераза создаёт транскрипты мРНК вирусного генома. Оставаясь в ядре вириона, вирусная РНК избегает врождённого иммунного ответа, называемого РНК-интерференцией и вызываемого присутствием двухцепочечной РНК.
Во время инфекции ротавирус производит мРНК для биосинтеза белка и репликации генов. Большинство ротавирусных белков накапливается в вироплазмах, где реплицируется РНК и собираются DLP. Вироплазмы формируются вокруг ядра клетки уже через два часа после начала вирусной инфекции и состоят из вирусных фабрик, создаваемых, как предполагается, двумя вирусными неструктурными белками: NSP5 и NSP2. Ингибирование NSP5 РНК-интерференцией приводит к резкому снижению репликации ротавирусов. DLP мигрируют в эндоплазматический ретикулум, где они получают свой третий, внешний, слой (образованный VP7 и VP4). Потомство вируса высвобождается из клетки путём лизиса[21][40][41].
Передача

Ротавирусы передаются фекально-оральным путем, при контакте с загрязненными руками, поверхностями и предметами[42] и, возможно, дыхательным путем[43]. Вирусная диарея очень заразна. Фекалии инфицированного человека могут содержать более 10 триллионов инфекционных частиц на грамм[44]; для передачи инфекции другому человеку требуется менее 100 из них[45].
Ротавирусы стабильны в окружающей среде и были обнаружены в образцах устья реки в количестве до 1-5 инфекционных частиц на галлон США. Вирусы выживают от 9 до 19 дней[46]. Санитарные меры, достаточные для уничтожения бактерий и паразитов, по-видимому, неэффективны в борьбе с ротавирусом, поскольку заболеваемость ротавирусной инфекцией в странах с высокими и низкими стандартами здравоохранения одинакова[43].
Признаки и симптомы
Ротавирусный энтерит — это заболевание от легкой до тяжелой степени, характеризующееся тошнотой, рвотой, водянистой диареей и субфебрильной температурой. Как только ребёнок заражается вирусом, проходит инкубационный период продолжительностью около двух дней, прежде чем появляются симптомы. Период болезни острый. Симптомы часто начинаются с рвоты, за которой следует от четырёх до восьми дней обильной диареи. Обезвоживание чаще встречается при ротавирусной инфекции, чем при большинстве случаев, вызванных бактериальными патогенами, и является наиболее частой причиной смерти, связанной с ротавирусной инфекцией[47].
Ротавирусные инфекции А могут возникать на протяжении всей жизни: первая обычно вызывает симптомы, но последующие инфекции обычно протекают в легкой или бессимптомной форме[48][44], поскольку иммунная система обеспечивает некоторую защиту[49]. Следовательно, частота симптоматических инфекций наиболее высока у детей в возрасте до двух лет и постепенно снижается к 45 годам[50]. Наиболее тяжелые симптомы, как правило, возникают у детей в возрасте от шести месяцев до двух лет, пожилых людей и людей с иммунодефицитом. Из-за иммунитета, приобретенного в детстве, большинство взрослых не восприимчивы к ротавирусу; у гастроэнтерита у взрослых обычно есть причина, отличная от ротавирусной, но бессимптомные инфекции у взрослых могут поддерживать передачу инфекции в сообществе[51]. Есть некоторые свидетельства того, что группа крови может влиять на восприимчивость к заражению ротавирусами[52].
Механизмы заболевания

Ротавирусы размножаются в основном в кишечнике[53] и поражают энтероциты ворсинок тонкой кишки, что приводит к структурным и функциональным изменениям эпителия[54]. У людей, и особенно на животных моделях, имеются доказательства внекишечного распространения инфекционного вируса в другие органы и макрофаги[55].
Диарея вызывается множественной активностью вируса[56]. Нарушение всасывания происходит из-за разрушения клеток кишечника, называемых энтероцитами. Токсичный белок ротавируса NSP4 индуцирует возрастную и кальций-зависимую секрецию хлорида, нарушает реабсорбцию воды, опосредованную транспортером SGLT1 (котранспортер натрия / глюкозы 2), по-видимому, снижает активность дисахаридаз мембран щеточной каймы и активирует кальций-зависимые секреторные рефлексы кишечной нервной системы[57]. Повышенная концентрация ионов кальция в цитозоле (которые необходимы для сборки вирусов-потомков) достигается за счет NSP4, действующего как виропорин. Это увеличение ионов кальция приводит к аутофагии (саморазрушению) инфицированных энтероцитов[58].
NSP4 также секретируется. Эта внеклеточная форма, которая модифицируется ферментами протеазы в кишечнике, представляет собой энтеротоксин, который действует на неинфицированные клетки через рецепторы интегрина, что, в свою очередь, вызывает и увеличивает внутриклеточную концентрацию ионов кальция, секреторную диарею и аутофагию[59].
Рвота, характерная для ротавирусного энтерита, вызывается вирусом, поражающим энтерохромаффинные клетки на слизистой оболочке пищеварительного тракта. Инфекция стимулирует выработку 5'-гидрокситриптамина (серотонина). Это активирует блуждающие афферентные нервы, которые, в свою очередь, активируют клетки ствола головного мозга, которые контролируют рвотный рефлекс[60].
Здоровые энтероциты выделяют лактазу в тонкий кишечник; непереносимость молока из-за дефицита лактазы является симптомом ротавирусной инфекции[61], которая может сохраняться неделями[62]. Повторение легкой диареи часто следует за повторным введением молока в рацион ребёнка из-за бактериальной ферментации дисахарида лактозы в кишечнике[63].
Иммунные реакции
Конкретные ответы
Ротавирусы вызывают как В-, так и Т-клеточный иммунный ответ. Антитела к белкам ротавируса VP4 и VP7 нейтрализуют вирусную инфекционность in vitro и in vivo[64]. Вырабатываются специфические антитела классов IgM, IgA и IgG, которые, как было показано, защищают от ротавирусной инфекции путем пассивного переноса антител у других животных[65]. Материнский трансплацентарный IgG может играть определённую роль в защите новорожденных от ротавирусных инфекций, но, с другой стороны, может снизить эффективность вакцины[66].
Врожденные реакции
После заражения ротавирусами возникает быстрый врожденный иммунный ответ, включающий интерфероны I и III типов и другие цитокины (в частности, Th1 и Th2[67]), которые ингибируют репликацию вируса и рекрутируют макрофаги и естественные клетки-киллеры в инфицированные ротавирусом клетки[68]. Ротавирусная дцРНК активирует рецепторы распознавания образов, такие как toll-подобные рецепторы[69], которые стимулируют выработку интерферонов. Ротавирусный белок NSP1 противодействует эффектам интерферонов 1-го типа, подавляя активность регуляторных белков интерферона IRF3, IRF5 и IRF7[69].
Маркеры защиты
Уровни IgG и IgA в крови и IgA в кишечнике коррелируют с защитой от инфекции[70]. Было заявлено, что специфичные для ротавируса сывороточные IgG и IgA в высоких титрах (например, > 1: 200) являются защитными, и существует значительная корреляция между титрами IgA и эффективностью ротавирусной вакцины[71].
Диагностика и выявление
Диагноз заражения ротавирусом обычно следует за диагнозом гастроэнтерита как причины тяжелой диареи. Большинство детей, поступивших в больницу с гастроэнтеритом, проходят тестирование на ротавирус А[72][73]. Специфический диагноз заражения ротавирусом А ставится путем обнаружения вируса в кале ребёнка методом иммуноферментного анализа. На рынке имеется несколько лицензированных тест-наборов, которые являются чувствительными, специфичными и обнаруживают все серотипы ротавируса A[74]. Другие методы, такие как электронная микроскопия и ПЦР (полимеразная цепная реакция), используются в исследовательских лабораториях[75]. Полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР) позволяет обнаруживать и идентифицировать все виды и серотипы ротавирусов человека[76].
Лечение и прогноз
Лечение острой ротавирусной инфекции неспецифично и включает в себя лечение симптомов и, что наиболее важно, лечение обезвоживания[77]. При отсутствии лечения дети могут умереть от возникающего в результате сильного обезвоживания[78]. В зависимости от тяжести диареи лечение состоит из пероральной регидратационной терапии, во время которой ребёнку дают дополнительную воду для питья, содержащую определённое количество соли и сахара[79]. В 2004 году Всемирная организация здравоохранения (ВОЗ) и ЮНИСЕФ рекомендовали использовать раствор для пероральной регидратации с низкой осмолярностью и прием добавок цинка как двустороннее средство лечения острой диареи[80]. Некоторые инфекции достаточно серьёзны, чтобы потребовать госпитализации, при которой вводятся жидкости путем внутривенной терапии или назогастральной интубации, а также контролируется уровень электролитов и сахара в крови ребёнка[72]. Ротавирусные инфекции редко вызывают другие осложнения, и для хорошо обследованного ребёнка прогноз отличный[81]. Было показано, что пробиотики сокращают продолжительность ротавирусной диареи[82], и согласно Европейскому обществу детской гастроэнтерологии «эффективные вмешательства включают введение специфических пробиотиков, таких как Lactobacillus rhamnosus или Saccharomyces boulardii, диосмектит или рацекадотрил»[83].
См. также
Примечания
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ 2,0 2,1 Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV). (Дата обращения: 19 ноября 2021).
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии : Учебное пособие для студентов медицинских вузов / Под ред. А. А. Воробьева, А. С. Быкова. — М. : Медицинское информационное агентство, 2003. — С. 117. — ISBN 5-89481-136-8.
- ↑ Грачева Н. М., Аваков А. А., Блохина Т. А., Щербаков И. Т. Клинические аспекты ротавирусной инфекции // Лечащий врач. — 1998. — № 3. — ISSN 1560-5175. Архивировано 28 декабря 2014 года.
- ↑ 5,0 5,1 Kirkwood C. D. Genetic and antigenic diversity of human rotaviruses: potential impact on vaccination programs (англ.) // The Journal of Infectious Diseases : journal. — 2010. — September (vol. 202, no. Suppl). — P. S43—S48. — doi:10.1086/653548. — PMID 20684716.
- ↑ O'Ryan M. The ever-changing landscape of rotavirus serotypes (неопр.) // The Pediatric Infectious Disease Journal. — 2009. — March (т. 28, № 3 Suppl). — С. S60—S62. — doi:10.1097/INF.0b013e3181967c29. — PMID 19252426.
- ↑ Patton J.T. Rotavirus diversity and evolution in the post-vaccine world (англ.) // Discovery Medicine : journal. — 2012. — January (vol. 13, no. 68). — P. 85—97. — PMID 22284787. Архивировано 23 сентября 2015 года.
- ↑ Desselberger U., Wolleswinkel-van den Bosch J., Mrukowicz J., Rodrigo C., Giaquinto C., Vesikari T. Rotavirus types in Europe and their significance for vaccination (англ.) // Pediatr. Infect. Dis. J. : journal. — 2006. — Vol. 25, no. 1 Suppl.. — P. S30—S41. — doi:10.1097/01.inf.0000197707.70835.f3. — PMID 16397427. Архивировано 11 мая 2013 года.
- ↑ Desselberger, U.; Gray, James. Rotaviruses: methods and protocols (англ.) / Desselberger, U.; Gray, James. — Totowa, N. J.: Humana Press[англ.], 2000. — P. 2. — ISBN 0-89603-736-3.
- ↑ Carter J., & Saunders V. A. (2007). Virology: principles and applications. John Wiley & Sons; 148—151.
- ↑ 11,0 11,1 Pesavento J. B., Crawford S. E., Estes M. K., Prasad B. V. Rotavirus proteins: structure and assembly (англ.) // Curr. Top. Microbiol. Immunol.. — 2006. — Vol. 309. — P. 189—219. — doi:10.1007/3-540-30773-7_7. — PMID 16913048.
- ↑ Prasad B. V., Chiu W. Structure of rotavirus (англ.) // Curr. Top. Microbiol. Immunol.. — 1994. — Vol. 185. — P. 9—29. — PMID 8050286.
- ↑ Patton J. T. Structure and function of the rotavirus RNA-binding proteins (англ.) // Journal of General Virology[англ.] : journal. — Microbiology Society[англ.], 1995. — Vol. 76, no. 11. — P. 2633—2644. — doi:10.1099/0022-1317-76-11-2633. — PMID 7595370. Архивировано 9 декабря 2012 года.
- ↑ Patton J. T. Rotavirus RNA replication and gene expression (неопр.) // Novartis Found. Symp.. — 2001. — Т. 238. — С. 64—77; discussion 77—81. — doi:10.1002/0470846534.ch5. — PMID 11444036.
- ↑ Vásquez-del Carpió R., Morales J. L., Barro M., Ricardo A., Spencer E. Bioinformatic prediction of polymerase elements in the rotavirus VP1 protein (англ.) // Biol. Res. : journal. — 2006. — Vol. 39, no. 4. — P. 649—659. — doi:10.4067/S0716-97602006000500008. — PMID 17657346. Архивировано 1 декабря 2017 года.
- ↑ Arnoldi F., Campagna M., Eichwald C., Desselberger U., Burrone O. R. Interaction of rotavirus polymerase VP1 with nonstructural protein NSP5 is stronger than that with NSP2 (англ.) // J. Virol. : journal. — 2007. — Vol. 81, no. 5. — P. 2128—2137. — doi:10.1128/JVI.01494-06. — PMID 17182692. Архивировано 28 сентября 2011 года.
- ↑ Angel J., Franco M. A., Greenberg H. B. Desk Encyclopedia of Human and Medical Virology (англ.) / Mahy B. W. J., Van Regenmortel M. H. V.. — Boston: Academic Press, 2009. — P. 277. — ISBN 0-12-375147-0.
- ↑ Cowling V. H. Regulation of mRNA cap methylation (англ.) // Biochem. J.. — 2010. — January (vol. 425, no. 2). — P. 295—302. — doi:10.1042/BJ20091352. — PMID 20025612.
- ↑ Gardet A., Breton M., Fontanges P., Trugnan G., Chwetzoff S. Rotavirus spike protein VP4 binds to and remodels actin bundles of the epithelial brush border into actin bodies (англ.) // J. Virol. : journal. — 2006. — Vol. 80, no. 8. — P. 3947—3956. — doi:10.1128/JVI.80.8.3947-3956.2006. — PMID 16571811. Архивировано 28 сентября 2011 года.
- ↑ Arias C. F., Isa P., Guerrero C. A., Méndez E., Zárate S., López T., Espinosa R., Romero P., López S. Molecular biology of rotavirus cell entry (неопр.) // Arch. Med. Res.. — 2002. — Т. 33, № 4. — С. 356—361. — doi:10.1016/S0188-4409(02)00374-0. — PMID 12234525.
- ↑ 21,0 21,1 Jayaram H., Estes M. K., Prasad B. V. Emerging themes in rotavirus cell entry, genome organization, transcription and replication (англ.) // Virus Research : journal. — 2004. — April (vol. 101, no. 1). — P. 67—81. — doi:10.1016/j.virusres.2003.12.007. — PMID 15010218.
- ↑ Bishop R. F. Natural history of human rotavirus infection (англ.) // Arch. Virol. Suppl.. — 1996. — Vol. 12. — P. 119—128. — PMID 9015109.
- ↑ Beards G. M., Campbell A. D., Cottrell N. R., Peiris J. S., Rees N., Sanders R. C., Shirley J. A., Wood H. C., Flewett T. H. Enzyme-linked immunosorbent assays based on polyclonal and monoclonal antibodies for rotavirus detection (англ.) // J. Clin. Microbiol. : journal. — 1984. — 1 February (vol. 19, no. 2). — P. 248—254. — PMID 6321549. Архивировано 27 сентября 2011 года.
- ↑ Hua J., Mansell E. A., Patton J. T. Comparative analysis of the rotavirus NS53 gene: conservation of basic and cysteine-rich regions in the protein and possible stem-loop structures in the RNA (англ.) // Virology : journal. — 1993. — Vol. 196, no. 1. — P. 372—378. — doi:10.1006/viro.1993.1492. — PMID 8395125.
- ↑ Arnold M.M. The Rotavirus Interferon Antagonist NSP1: Many Targets, Many Questions (англ.) // Journal of Virology : journal. — 2016. — Vol. 90, no. 11. — P. 5212—5215. — doi:10.1128/JVI.03068-15. — PMID 27009959.
- ↑ Kattoura M. D., Chen X., Patton J. T. The rotavirus RNA-binding protein NS35 (NSP2) forms 10S multimers and interacts with the viral RNA polymerase (англ.) // Virology : journal. — 1994. — Vol. 202, no. 2. — P. 803—813. — doi:10.1006/viro.1994.1402. — PMID 8030243.
- ↑ Taraporewala Z. F., Patton J. T. Nonstructural proteins involved in genome packaging and replication of rotaviruses and other members of the Reoviridae (англ.) // Virus Res. : journal. — 2004. — Vol. 101, no. 1. — P. 57—66. — doi:10.1016/j.virusres.2003.12.006. — PMID 15010217.
- ↑ Poncet D., Aponte C., Cohen J. Rotavirus protein NSP3 (NS34) is bound to the 3' end consensus sequence of viral mRNAs in infected cells (англ.) // J. Virol. : journal. — 1993. — 1 June (vol. 67, no. 6). — P. 3159—3165. — PMID 8388495. Архивировано 28 сентября 2011 года.
- ↑ López, S; Arias, C.F. Rotavirus-host cell interactions: an arms race (англ.) // Current Opinion in Virology. — Elsevier, 2012. — August (vol. 2, no. 4). — P. 389—398. — doi:10.1016/j.coviro.2012.05.001. — PMID 22658208.
- ↑ Hyser J. M., Estes M. K. Rotavirus vaccines and pathogenesis: 2008 (англ.) // Current Opinion in Gastroenterology. — Lippincott Williams & Wilkins[англ.], 2009. — January (vol. 25, no. 1). — P. 36—43. — doi:10.1097/MOG.0b013e328317c897. — PMID 19114772. Архивировано 11 мая 2013 года.
- ↑ Afrikanova I., Miozzo M. C., Giambiagi S., Burrone O. Phosphorylation generates different forms of rotavirus NSP5 (англ.) // Journal of General Virology[англ.] : journal. — Microbiology Society[англ.], 1996. — Vol. 77, no. 9. — P. 2059—2065. — doi:10.1099/0022-1317-77-9-2059. — PMID 8811003. Архивировано 26 мая 2012 года.
- ↑ Rainsford E. W., McCrae M. A. Characterization of the NSP6 protein product of rotavirus gene 11 (англ.) // Virus Res. : journal. — 2007. — Vol. 130, no. 1—2. — P. 193—201. — doi:10.1016/j.virusres.2007.06.011. — PMID 17658646.
- ↑ Mohan K. V., Atreya C. D. Nucleotide sequence analysis of rotavirus gene 11 from two tissue culture-adapted ATCC strains, RRV and Wa (англ.) // Virus Genes : journal. — 2001. — Vol. 23, no. 3. — P. 321—329. — doi:10.1023/A:1012577407824. — PMID 11778700.
- ↑ Desselberger U. Rotavirus: basic facts. In Rotaviruses Methods and Protocols. Ed. Gray, J. and Desselberger U. Humana Press, 2000, pp. 1—8. ISBN 0-89603-736-3
- ↑ Patton J. T. Rotavirus RNA replication and gene expression. In Novartis Foundation. Gastroenteritis Viruses, Humana Press, 2001, pp. 64—81. ISBN 0-471-49663-4
- ↑ Claude M. Fauquet; J. Maniloff; Desselberger, U. Virus taxonomy: classification and nomenclature of viruses: 8th report of the International Committee on Taxonomy of Viruses (англ.). — Amsterdam: Elsevier/Academic Press, 2005. — P. 489. — ISBN 0-12-249951-4.
- ↑ Greenberg H. B., Estes M. K. Rotaviruses: from pathogenesis to vaccination (неопр.) // Gastroenterology. — 2009. — May (т. 136, № 6). — С. 1939—1951. — doi:10.1053/j.gastro.2009.02.076. — PMID 19457420.
- ↑ Greenberg H. B., Clark H. F., Offit P. A. Rotavirus pathology and pathophysiology (англ.) // Curr. Top. Microbiol. Immunol.. — 1994. — Vol. 185. — P. 255—283. — PMID 8050281.
- ↑ Baker M., Prasad B. V. Rotavirus cell entry (англ.) // Current Topics in Microbiology and Immunology. — 2010. — Vol. 343. — P. 121—148. — doi:10.1007/82_2010_34. — PMID 20397068.
- ↑ Patton J. T., Vasquez-Del Carpio R., Spencer E. Replication and transcription of the rotavirus genome (англ.) // Curr. Pharm. Des. : journal. — 2004. — Vol. 10, no. 30. — P. 3769—3777. — doi:10.2174/1381612043382620. — PMID 15579070.
- ↑ Ruiz M. C., Leon T., Diaz Y., Michelangeli F. Molecular biology of rotavirus entry and replication (англ.) // TheScientificWorldJournal : journal. — 2009. — Vol. 9. — P. 1476—1497. — doi:10.1100/tsw.2009.158. — PMID 20024520.
- ↑ (1993) «Prevalence of rotavirus on high-risk fomites in day-care facilities». Pediatrics 92 (2): 202–205. doi:10.1542/peds.92.2.202. PMID 8393172.
- ↑ 43,0 43,1 Dennehy PH (2000). «Transmission of rotavirus and other enteric pathogens in the home». Pediatric Infectious Disease Journal 19 (Suppl 10): S103–105. doi:10.1097/00006454-200010001-00003. PMID 11052397.
- ↑ 44,0 44,1 Bishop RF. Natural history of human rotavirus infection // Viral Gastroenteritis. — 1996. — Vol. 12. — P. 119–128. — ISBN 978-3-211-82875-5. — doi:10.1007/978-3-7091-6553-9_14.
- ↑ (2009) «Rotavirus vaccines: opportunities and challenges». Human Vaccines 5 (2): 57–69. doi:10.4161/hv.5.2.6924. PMID 18838873.
- ↑ (1984) «Isolation of enteroviruses from water, suspended solids, and sediments from Galveston Bay: survival of poliovirus and rotavirus adsorbed to sediments» (PDF). Applied and Environmental Microbiology 48 (2): 404–409. doi:10.1128/AEM.48.2.404-409.1984. PMID 6091548. .
- ↑ (1990) «Rotavirus». Baillière's Clinical Gastroenterology 4 (3): 609–625. doi:10.1016/0950-3528(90)90052-I. PMID 1962726.
- ↑ (2006) «Rotavirus vaccines: current prospects and future challenges». The Lancet 368 (9532): 323–332. doi:10.1016/S0140-6736(06)68815-6. PMID 16860702.
- ↑ Offit PA. Gastroenteritis viruses. — New York : Wiley, 2001. — P. 106–124. — ISBN 978-0-471-49663-2.
- ↑ Epidemiology of Group A Rotaviruses: Surveillance and Burden of Disease Studies // Rotaviruses: Methods and Protocols. — Totowa, NJ : Humana Press, 2000. — Vol. 34. — P. 217–238. — ISBN 978-0-89603-736-6. — doi:10.1385/1-59259-078-0:217.
- ↑ (2004) «Rotavirus infection in adults». The Lancet Infectious Diseases 4 (2): 91–99. doi:10.1016/S1473-3099(04)00928-4. PMID 14871633.
- ↑ (November 2020) «The role of host genetics in susceptibility to severe viral infections in humans and insights into host genetics of severe COVID-19: A systematic review». Virus Research 289: 198163. doi:10.1016/j.virusres.2020.198163. PMID 32918943.
- ↑ (2009) «Rotaviruses: from pathogenesis to vaccination». Gastroenterology 136 (6): 1939–1951. doi:10.1053/j.gastro.2009.02.076. PMID 19457420.
- ↑ Rotavirus pathology and pathophysiology // Rotaviruses. — New York : Springer, 1994. — Vol. 185. — P. 255–283. — ISBN 9783540567615. — doi:10.1007/978-3-642-78256-5_9.
- ↑ (2006) «Rotavirus viremia and extraintestinal viral infection in the neonatal rat model». Journal of Virology 80 (10): 4820–4832. doi:10.1128/JVI.80.10.4820-4832.2006. PMID 16641274.
- ↑ (2004) «Pathogenesis of intestinal and systemic rotavirus infection». Journal of Virology 78 (19): 10213–10220. doi:10.1128/JVI.78.19.10213-10220.2004. PMID 15367586.
- ↑ (2009) «Rotavirus vaccines and pathogenesis: 2008». Current Opinion in Gastroenterology 25 (1): 36–43. doi:10.1097/MOG.0b013e328317c897. PMID 19114772.
- ↑ (2010) «Rotavirus disrupts calcium homeostasis by NSP4 viroporin activity». mBio 1 (5). doi:10.1128/mBio.00265-10. PMID 21151776.
- ↑ (2006) «Rotavirus NSP4 induces a novel vesicular compartment regulated by calcium and associated with viroplasms». Journal of Virology 80 (12): 6061–6071. doi:10.1128/JVI.02167-05. PMID 16731945.
- ↑ (2012) «Towards a human rotavirus disease model». Current Opinion in Virology 2 (4): 408–418. doi:10.1016/j.coviro.2012.05.006. PMID 22722079.
- ↑ Farnworth ER (2008). «The evidence to support health claims for probiotics». The Journal of Nutrition 138 (6): 1250S–1254S. doi:10.1093/jn/138.6.1250S. PMID 18492865.
- ↑ (2003) «Health aspects of probiotics». IDrugs: The Investigational Drugs Journal 6 (6): 573–580. PMID 12811680.
- ↑ Arya SC (1984). «Rotaviral infection and intestinal lactase level». Journal of Infectious Diseases 150 (5). doi:10.1093/infdis/150.5.791. PMID 6436397.
- ↑ (2009) «Mechanisms of protection against rotavirus infection and disease». The Pediatric Infectious Disease Journal 28 (Suppl 3): S57–S59. doi:10.1097/INF.0b013e3181967c16. PMID 19252425.
- ↑ (2012) «IgY antibodies protect against human Rotavirus induced diarrhea in the neonatal gnotobiotic piglet disease model». PLOS ONE 7 (8): e42788. doi:10.1371/journal.pone.0042788. PMID 22880110. .
- ↑ (2017) «Contribution of Maternal Immunity to Decreased Rotavirus Vaccine Performance in Low- and Middle-Income Countries». Clinical and Vaccine Immunology 24 (1). doi:10.1128/CVI.00405-16. PMID 27847365.
- ↑ (2017) «Cytokines in the management of rotavirus infection: A systematic review of in vivo studies». Cytokine 96: 152–160. doi:10.1016/j.cyto.2017.04.013. PMID 28414969.
- ↑ (2013) «Innate cellular responses to rotavirus infection». The Journal of General Virology 94 (6): 1151–1160. doi:10.1099/vir.0.051276-0. PMID 23486667.
- ↑ 69,0 69,1 (2016) «Intestinal Innate Antiviral Immunity and Immunobiotics: Beneficial Effects against Rotavirus Infection». Frontiers in Immunology 7: 563. doi:10.3389/fimmu.2016.00563. PMID 27994593.
- ↑ Rotaviruses: immunological determinants of protection against infection and disease // Advances in Virus Research Volume 44. — 1994. — Vol. 44. — P. 161–202. — ISBN 9780120398447. — doi:10.1016/S0065-3527(08)60329-2.
- ↑ (2013) «A systematic review of anti-rotavirus serum IgA antibody titer as a potential correlate of rotavirus vaccine efficacy». The Journal of Infectious Diseases 208 (2): 284–294. doi:10.1093/infdis/jit166. PMID 23596320.
- ↑ 72,0 72,1 (2007) «Routine laboratory testing data for surveillance of rotavirus hospitalizations to evaluate the impact of vaccination». The Pediatric Infectious Disease Journal 26 (10): 914–919. doi:10.1097/INF.0b013e31812e52fd. PMID 17901797.
- ↑ The Pediatric ROTavirus European CommitTee (PROTECT) (2006). «The paediatric burden of rotavirus disease in Europe». Epidemiology and Infection 134 (5): 908–916. doi:10.1017/S0950268806006091. PMID 16650331.
- ↑ Desk Encyclopedia of Human and Medical Virology. — Boston : Academic Press, 2009. — P. 278. — ISBN 978-0-12-375147-8.
- ↑ Gastroenteritis viruses. — New York : Wiley, 2001. — P. 14. — ISBN 978-0-471-49663-2.
- ↑ (2004) «Rotavirus typing methods and algorithms». Reviews in Medical Virology 14 (2): 71–82. doi:10.1002/rmv.411. PMID 15027000.
- ↑ Diggle L (2007). «Rotavirus diarrhea and future prospects for prevention». British Journal of Nursing 16 (16): 970–974. doi:10.12968/bjon.2007.16.16.27074. PMID 18026034.
- ↑ (2003) «Treatment of infectious diarrhea in children». Paediatric Drugs 5 (3): 151–165. doi:10.2165/00128072-200305030-00002. PMID 12608880.
- ↑ Sachdev HP (1996). «Oral rehydration therapy». Journal of the Indian Medical Association 94 (8): 298–305. PMID 8855579.
- ↑ World Health Organization, UNICEF. Joint Statement: Clinical Management of Acute Diarrhoea. Дата обращения: 3 мая 2012.
- ↑ Ramig RF (2007). «Systemic rotavirus infection». Expert Review of Anti-infective Therapy 5 (4): 591–612. doi:10.1586/14787210.5.4.591. PMID 17678424.
- ↑ (2015) «Efficacy of probiotic use in acute rotavirus diarrhea in children: A systematic review and meta-analysis». Caspian Journal of Internal Medicine 6 (4): 187–195. PMID 26644891.
- ↑ (2014) «European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: update 2014». Journal of Pediatric Gastroenterology and Nutrition 59 (1): 132–152. doi:10.1097/MPG.0000000000000375. PMID 24739189.