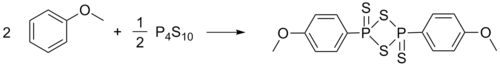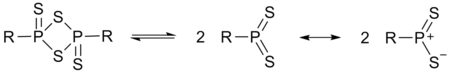Реагент Лавессона
| Реагент Лавессона | |
|---|---|
| Общие | |
| Систематическое наименование |
2,4-бис(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфид |
| Сокращения | LR |
| Традиционные названия | Реагент Лавессона |
| Физические свойства | |
| Молярная масса | 404.45 г/моль |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
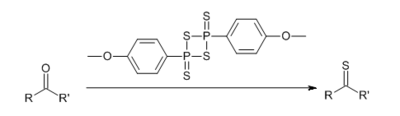
Реагент Лавессона — замещенный дитиофосфетан, использующийся в качестве тионирующего агента в органическом синтезе:
Желтоватые гигроскопичные кристаллы с неприятным запахом (гидролизуется с выделением сероводорода), растворимые при нагревании в ароматических растворителях (толуол, хлорбензол, анизол) и диметоксиэтане, слаборастворимые в эфире[1].
Впервые был синтезирован в 1956 г. в ходе исследования реакций пентасульфида фосфора P4S10 с ароматическими соединениями[2], в синтетическую практику в качестве тионирующего агента введен Свеном-Олафом Лавессоном.
Синтез
Реагент Лавессона синтезируют взаимодействием эквивалентных количеств пентасульфида фосфора и анизола, реакция идёт при нагревании с обратным холодильником при температуре кипения анизола, реактив Лавессона кристаллизуется при охлаждении реакционной смеси. Выход (без перекристаллизации) составляет 79-87 %[3]:
Продукт может быть дополнительно очищен перекристаллизацией из кипящего толуола[1], однако в большинстве случаев может использован для тионирования без перекристаллизации.
Механизм тионирования
Реагент Лавессона в растворе существует в равновесии с образующимся из него нуклеофильным дитиофосфинилидом:
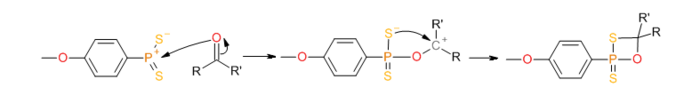
Реакция карбонила с этим илидом ведет к образованию тиаоксофосфетанового интермедиата:
который затем распадается с образованием тиокарбонильного соединения:
Механизм реакции сходен с механизмом реакции Виттига, в обоих случаях происходит образование четырёхчленного интермедиата со связью P-O и движущей силой реакции является образование высокостабильной связи P=O.
Синтетическое применение
Реагент Лавессона применяют для тионирования кетонов, амидов и лактамов. Лактоны также могут быть тионированы и некоторые сложные эфиры (например, этиловый эфир пирослизевой кислоты)[4], однако сложные эфиры алифатических карбоновых кислот тионируются с низкими выходами.
Выходы при тионировании N,N-дизамещенных амидов колеблются от высоких (например, при тионировании N-метилпирролидона выход количественный[3]) до низких, в последнем случае вместо использования реагента Лавессона предпочтительней использование реагента Дэвиса, который дает высокие выходы N,N-дизамещенных амидов[5].
Реакция с 1,4-дикарбонильными соединениями ведет к образованию тиофенов[6]. Аналогично идет реакция с их аза-аналогами, так, амиды α-амино-β-кетокислот под действием реагента Лавессона образуют тиазолы[7].
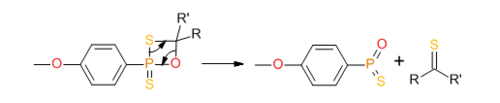
Реагент Лавессона также применяется для тионирования фосфиноксидов с образованием фосфинсульфидов[8]:
- R3P=O + LR [math]\displaystyle{ \to }[/math] R3P=S
См. также
- Реагент Вулинса — селеновый аналог реагента Лавессона, использующийся для селенирования карбонильных соединений.
- Реагент Дэви — аналог реактива Лавессона, использующийся для тионирования амидов и лактамов.
Литература
(2003-09) «Applications of Lawesson’s Reagent in Organic and Organometallic Syntheses». Synthesis 2003 (13): 1929–1958. doi:10.1055/s-2003-41447. ISSN 0039-7881. Проверено 2021-02-03.
Примечания
- ↑ Перейти обратно: 1,0 1,1 Voss, Jürgen. 2,4-Bis(4-methoxyphenyl)-1,3,2,4-dithiadiphosphetane 2,4-Disulfide // Encyclopedia of Reagents for Organic Synthesis / Jürgen Voss, Jürgen Voss. — American Cancer Society, 2006. — ISBN 978-0-470-84289-8.
- ↑ (1956) «The Phosphonation of Aromatic Compounds with Phosphorus Pentasulfide». J. Am. Chem. Soc. 78 (19): 5018. doi:10.1021/ja01600a058.
- ↑ Перейти обратно: 3,0 3,1 (1984) «Thiation with 2,4-bis(4-methoxyphenyl)-1,3,2,4- dithiadiphosphetane 2,4-disulfide: N-Methylthiopyrrolidone». Organic Syntheses 62: 158. doi:10.15227/orgsyn.062.0158. ISSN 00786209. Проверено 2021-02-03.
- ↑ (1999-09) «Microwave-Accelerated Solvent-Free Synthesis of Thioketones, Thiolactones, Thioamides, Thionoesters, and Thioflavonoids». Organic Letters 1 (5): 697–700. doi:10.1021/ol990629a. ISSN 1523-7060. Проверено 2021-02-03.
- ↑ Heimgartner, Heinz. 1,3,2,4-Dithiadiphosphetane, 2,4-bis[(4- methylphenyl)thio-2,4-disulfide] // Encyclopedia of Reagents for Organic Synthesis. — American Cancer Society, 2003. — ISBN 978-0-470-84289-8. Архивная копия от 8 февраля 2021 на Wayback Machine
- ↑ (2005) «Microwave-Assisted Paal–Knorr Reaction – Three-Step Regiocontrolled Synthesis of Polysubstituted Furans, Pyrroles and Thiophenes». European Journal of Organic Chemistry 2005 (24): 5277–5288. doi:https://doi.org/10.1002/ejoc.200500387[Ошибка: Неверный DOI!]. ISSN 1099-0690. Проверено 2021-02-03.
- ↑ (2009-12-04) «Solution versus Fluorous versus Solid-Phase Synthesis of 2,5-Disubstituted 1,3-Azoles. Preliminary Antibacterial Activity Studies». The Journal of Organic Chemistry 74 (23): 8988–8996. doi:10.1021/jo9016265. ISSN 0022-3263. Проверено 2021-02-03.
- ↑ (2020-01) «Synthesis of α,β-Unsaturated Phosphine Sulfides». Synthesis 52 (01): 141–149. doi:10.1055/s-0039-1690685. ISSN 0039-7881. Проверено 2021-02-03.
На эту статью не ссылаются другие статьи Руниверсалис. |