Нитрид лития
| Нитрид лития | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Нитрид лития |
| Традиционные названия | Азотистый литий |
| Хим. формула | Li3N |
| Физические свойства | |
| Состояние | зеленовато-чёрные или тёмно-красные кристаллы |
| Молярная масса | 34,82 г/моль |
| Плотность | 1,28 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 813, 845 °C |
| • кипения | разлагается °C |
| Мол. теплоёмк. | 75,2 Дж/(моль·К) |
| Энтальпия | |
| • образования | -164,0 кДж/моль |
| Классификация | |
| Рег. номер CAS | 26134-62-3 |
| SMILES | |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитри́д ли́тия — соединение щелочного металла лития и азота, зеленовато-чёрные или тёмно-красные кристаллы.
Единственный устойчивый нитрид щелочных металлов.
Применяется в пиротехнике.
Получение
Синтезом из элементов — при комнатной температуре влажный азот медленно взаимодействует с литием, увеличение температуры и давления ускоряет реакцию:
- [math]\ce{ 6Li + N2 ->[\ce{300^{o}C}] 2Li3N. }[/math]
Взаимодействием гидрида лития с азотом:
- [math]\ce{ 3 LiH + N2 ->[\ce{500^{o}C}] Li3N + NH3. }[/math]
При хранении металлического лития в воздушной атмосфере при нормальных условиях наряду с карбонатом лития и гидроксидом лития в поверхностной плёнке образуется также нитрид лития.
Физические свойства
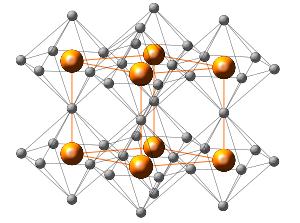
Нитрид лития образует в зависимости от отклонения от стехиометрического состава зеленовато-чёрные или тёмно-красные кристаллы.
Нитрид лития эндотермическое соединение, энтальпия его образования из элементов −207 кДж/моль[1].
В нормальных условиях устойчива кристаллическая структура гексагональной сингонии, называемая [math]\ce{ \alpha-Li3N }[/math], имеющая пространственная группу P 6/mmm, параметры кристаллической ячейки a = 0,3655 нм, c = 0,3876, Z = 1.
При давлении свыше 4200 бар (4 100 атм) [math]\ce{ \alpha-Li3N }[/math] переходит в [math]\ce{ \beta-Li3N }[/math], имеющий структуру арсенида натрия ([math]\ce{ Na3As }[/math]). Пр повышении давления свыше 360 кбар [math]\ce{ \beta-Li3N }[/math] переходит в [math]\ce{ \gamma-Li3N }[/math] со структурой типа [math]\ce{ Li3Bi }[/math][2].
В кристалле [math]\ce{ \alpha-Li3N }[/math] атомы лития образуют гексагональную графитоподобную кристаллическую структуру, в одной из кристаллических плоскостей каждый атом азота окружён шестью атомами лития. Два дополнительных атома лития расположены в других соседних плоскостях над и под атомом азота и каждый атом азота в результате оказывается окружённым восемью атомами лития, расположенных в вершинах гексагональной бипирамиды[3][4][5].
Нитрид лития является твёрдым электролитом — обладает ионной электропроводимостью по ионам [math]\ce{ Li+ }[/math] с удельной проводимостью 2·10-4 1/(Ом·см) и энергией активации освобождения ионов лития из узлов кристаллической решётки 0,26 эВ (~24 кДж/моль). Допирование кристалла водородом увеличивает проводимость, в то время как легирование ионами металлов (Al, Cu, Mg) уменьшает его[6][7]. Установлено, что энергия активации межкристаллического переноса ионов лития выше чем внутрикристаллическая (~68,5 кДж/моль[8]).
[math]\ce{ \alpha-Li3N }[/math] является полупроводником с шириной запрещенной зоны ~2,1 эВ[2].
Нитрид лития изучался как вещество для компактного хранения газообразного водорода, абсорбция и десорбция водорода обратимы и происходят при сравнительно низкой температуре ~270 °C. В опытах было достигнуто поглощение водорода веществом до 11,5 % по массе[9].
Химические свойства
Реакция образования нитрида лития обратима и при повышении температуры в вакууме идёт процесс разложения на элементы:
- [math]\ce{ 2Li3N ->[\ce{400^{o}C}] 6Li + N2. }[/math]
Нитрид лития энергично взаимодействует с водой с образованием гидроксида лития и аммиака:
- [math]\ce{ Li3N + 3H2O ->3LiOH + NH3. }[/math]
Нитрид лития при повышенной температуре взаимодействует с водородом с образованием гидрида лития и аммиака:
- [math]\ce{ Li3N + 3H2 -> 3LiH + NH3. }[/math]
При взаимодействии нитрида лития с водородом при 300 °C и повышенном давлении (более 0,5 МПа) образуется смесь гидрида лития и амида лития[10]:
- [math]\ce{ Li3N\ {+}\ 2H2 -> [\ce{300^{o}C},\ \ 0.5\ MPa] LiNH2\ {+}\ 2LiH. }[/math]
Разлагается кислотами с образованием соответствующих кислоте солей лития и аммония:
- [math]\ce{ Li3N + 4HCl -> 3LiCl + NH4Cl. }[/math]
Известно также много смешанных нитридов лития, некоторые из них: [math]\ce{ LiMgN,\ LiZnN,\ Li3AlN2,\ Li5SiN3,\ Li5TiN3,\ Li5GeN3. }[/math]
Расплавленный нитрид лития агрессивен по отношению ко многим металлам (Fe, Cu, Ni, Pt и др.).
Применение
- Нитрид лития иногда используется как компонент при изготовлении пиротехнических смесей.
- Возможно применение вещества для компактного хранения водорода.
Примечания
- ↑ M. Guntz: Sur l'azoture de lithium. In: Compt. Rend. Hebd. Band 123, 1896, S. 995–997 (Труды этого автора можно найти в интернет-библиотеке Gallica. Следует произвести поиск (фр. Recherche) по фамилии.).
- ↑ 2,0 2,1 Solid-State Hydrogen Storage: Materials and Chemistry (англ.) / Walker, G.. — 2008. — P. §16.2.1 Lithium nitride and hydrogen:a historical perspective.
- ↑ Кристаллическая структура Li3N.
- ↑ Holleman A. F., Wiberg E., Wiberg N. Lehrbuch der Anorganischen Chemie. 101. Auflage. de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1153.
- ↑ Barker M. G.; Blake A. J.; Edwards P. P.; Gregory D. H.; Hamor T. A.; Siddons D. J.; Smith S. E. Novel layered lithium nitridonickelates; effect of Li vacancy concentration on N co-ordination geometry and Ni oxidation state (англ.) // Chemical Communications : journal. — 1999. — No. 13. — P. 1187—1188. — doi:10.1039/a902962a.
- ↑ Lapp, Torben; Skaarup, Steen; Hooper, Alan. Ionic conductivity of pure and doped Li3N (неопр.) // Solid State Ionics. — 1983. — October (т. 11, № 2). — С. 97—103. — doi:10.1016/0167-2738(83)90045-0.
- ↑ Boukamp, B. A.; Huggins, R. A. Lithium ion conductivity in lithium nitride (англ.) // Physics Letters A[англ.] : journal. — 1976. — 6 September (vol. 58, no. 4). — P. 231—233. — doi:10.1016/0375-9601(76)90082-7.
- ↑ Boukamp, B. A.; Huggins, R. A. Fast ionic conductivity in lithium nitride (неопр.) // Materials Research Bulletin. — 1978. — January (т. 13, № 1). — С. 23—32. — doi:10.1016/0025-5408(78)90023-5.
- ↑ Ping Chen; Zhitao Xiong; Jizhong Luo; Jianyi Lin; Kuang Lee Tan. Interaction of hydrogen with metal nitrides and amides (англ.) // Nature : journal. — 2002. — Vol. 420, no. 6913. — P. 302—304. — doi:10.1038/nature01210. — PMID 12447436.
- ↑ Goshome1, Kiyotaka; Miyaoka2, Hiroki; Yamamoto1, Hikaru; Ichikawa3, Tomoyuki; Ichikawa1, Takayuki; Kojima1, Yoshitsugu. Ammonia Synthesis via Non-Equilibrium Reaction of Lithium Nitride in Hydrogen Flow Condition (англ.) // Materials TransactionS : journal. — 2015. — Vol. 56. — P. 410—414. — doi:10.2320/matertrans.M2014382.
Литература
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Гринвуд, Норман Н., Эрншоу, А. Химия элементов в 2-х т. — М.: Бином. Лаборатория знаний, 2015.
