НАДФ-зависимая декарбоксилирующая малатдегидрогеназа
| НАДФ-малик энзим | |
|---|---|
| Идентификаторы | |
| Шифр КФ | 1.1.1.40 |
| Номер CAS | 9028-47-1 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9028-47-1 |
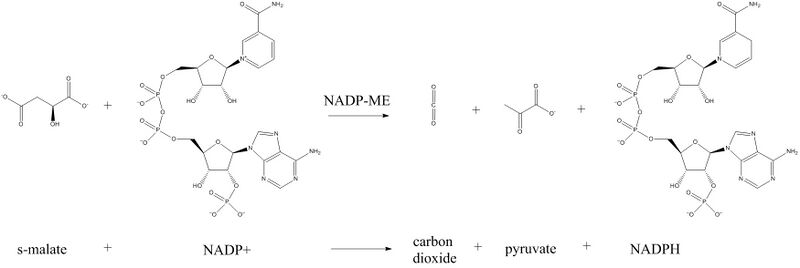
НАДФ-зависимая декарбоксилирующая малатдегидрогеназа или НАДФ-малик-энзим (НАДФ-МЭ) представляет собой фермент, катализирующий химическую реакцию в присутствии двухвалентных ионов металлов:
- (S)-малат + НАДФ+ -> пируват + CO2 + НАДФН
В качестве субстрата фермент использует (S)-малат и НАДФ+, при реакции образуются пируват, углекислый газ и НАДФН. В ходе реакции малат окисляется до пирувата и CO2, а НАДФ+ восстанавливается до НАДФН.
Фермент принадлежит к семейству оксидоредуктаз, а точнее, к ферментам, взаимодействующим с СН-OH группой донора, а в качестве акцептора использующих НАД+ или НАДФ+. Систематическое название этого фермента: (S)-малат: НАДФ+ оксидоредуктаза (оксалоацетат-декарбоксилаза). Малатдегидрогеназа участвует в метаболизме пирувата и связывании углерода. НАДФ-малик энзим является одним из трех ферментов декарбоксилирования, участвующих в концентрировании неорганического углерода у С4 и CAM-растений. Также к этому классу относятся НАД-малик-энзим и ФЕП-карбоксикиназа.[1][2] Хотя часто одна из трех фотосинтетических декарбоксилаз преобладает, также может встречаться одновременное включение активности всех трех ферментов[3].
Структура фермента

На основе кристаллографических данных гомологичного НАДФ-зависимого малик-энзима млекопитающих, была разработана 3D модель НАДФ-МЭ участвующего в C4 пути в растениях для выявления основных остатков, обеспечивающих связывание субстрата при катализе. Участок связывания НАДФ+ включает в себя два богатых глицином мотива — GXGXXG, гидрофобный желобок с участием минимум шести аминокислотных остатков и отрицательно заряженный остаток на конце ß-нити.[4][5] Первичная последовательность первого мотива, 240GLGDLG245, является консенсусным маркером для связывания фосфата, что подтверждает участие НАДФ+ в связывании, другие глицин-богатые мотивы принимают классическую укладку Россмана — также являющуюся типичным маркером для связывания НАДФ кофактора.[6]
Полученные путем искусственного мутагенеза растения кукурузу с дефицитом функции НАДФ-МЭ подтвердждают предложенную молекулярно-биологическую модель. Замена валина глицином в любом месте мотива приводит к полной инактивации фермента. При этом спектральный анализ не показывает существенных отличий от формы дикого типа. Данные свидетельствуют о нарушениях в главном остатке, участвующем в связывании и катализе, а не во междоменном остатке, влияющем на конформационную стабильность. Важную роль играет остаток аргинина в положении 237, взаимодействуя с малатом и НАДФ+, он участвует в формировании электростатического взаимодействия с отрицательно заряженной карбоксильной группой кислоты и фосфатной группой нуклеотида. Не известно, играет ли данный остаток важную роль в субстрат-связывающих взаимодействиях или же определяет положение субстрата при катализе.[7] Предполагается, что остаток лизина в положении 255 выступает в качестве каталитического основания. Однако, необходимы дальнейшие исследования для точного установления его биохимической роли.
Биологическая функция
Если рассматривать этот класс ферментов в общем, то малик-энзимы найдены у многих эукариотических организмов (от грибов до млекопитающих). Показана локализация ферментов на субклеточном уровне. Малик энзим присутствует в цитозоле, митохондриях и хлоропластах. В частности, у С4 растений НАДФ-МЭ локализован в хлоропластах клеток-обкладок проводящего пучка.
В ходе C4 фотосинтеза — биохимического пути, возникшего для концентрирования CO2 в месте его фиксации РуБисКО — углекислый газ попадает в клетки мезофилла и образует оксалоацетат. Затем, происходит восстановление оксалоацетата до малата. Малат транспортируется в клетки обкладки, где подвергается декарбоксилированию при участии НАДФ-МЭ. Поскольку в одну клетку обкладки поступает малат от нескольких клеток мезофилла, то в результате происходит концентрирование углекислого газа в месте его фиксации РуБисКо.[8]
Роль НАДФ-MЭ в коцентрировании углекислого газа подтверждается исследованием, проведенным на трансгенных растениях. Трансгенные растения с частичной потерей функции НАДФ-MЭ (40% активности НАДФ-ME от активности у дикого типа) наблюдалось значительное снижение уровня фиксации CO2 даже при высоком межклеточном содержании углекислого газа. Это говорит о важном значении НАДФ-MЭ в регуляции потока углерода, направленного к циклу Кальвина.
Регуляция активности фермента
Было показано, что экспрессия НАДФ-МЭ регулируется факторами абиотического стресса. Для CAM растений в условиях засухи характерно закрывание устьиц для избегания потери воды в результате испарения, которое приводит к голоданию по СО2. Этот процесс компенсируется за счёт того, что закрытие устьиц активирует трансляцию НАДФ-MЭ, что в свою очередь, во время коротких периодов поглощения СО2, увеличивает эффективность усвоения СО2,позволяя таким образом осуществлять фиксацию углерода.
В дополнение к длительному регулированию фермента посредством изменения экспрессии генов, существует кратковременное регулирование, которое может осуществляться за счёт аллостерических механизмов. Было показано, что для частичного ингибирования С4 НАДФ-МЭ субстратом, малат предположительно должен иметь два независимых сайта связывания: один в активном центре, а второй — аллостерический. Однако, ингибирующий эффект зависит от рН и проявляется лишь при рН = 7, но не 8. Наблюдение за изменением активности фермента в зависимости от изменения рН согласуются с гипотезой о том, что НАДФ-МЭ активен во время фотосинтеза: световые реакции приводят к повышению основности в строме хлоропласта — места локализации НАДФ-МЭ, что приводит к уменьшению ингибирующего влияния малата на НАДФ-МЭ, способствуя тем самым увеличению реакционной способности фермента. И наоборот, замедление световых реакций приводит к повышению кислотности среды в строме, вызывая ингибирование НАДФ-МЭ малатом. Необходимость регуляторного механизма объясняется тем, что для реакций цикла Кальвина требуются высокоэнергетические продукты световой фазы, НАДФН и АТФ, и,соответственно, процесс накопления СО2 без этих продуктов не является полезным.
Для этого белка можно использовать морфеиновую модель аллостерической регуляции.
Эволюция
НАДФ-малик энзим, как и все остальные С4 декарбоксилазы, не развился de novo с целью оказания помощи в фиксации СО2 РуБисКо. Наиболее вероятно, что НАДФ-МЭ был трансформирован из C3 вида в процессе фотосинтеза, но возможно также и более раннее происхождение из древнего цитозольного предка. В цитозоле, фермент существовал как ряд изоформ "домашнего хозяйства", предназначенных для выполнения различных функций, включая поддержание уровня малата во время гипоксии, удаление микроспор и защиту от патогенов. Относительно механизма эволюции, считается, что С4 функциональность была вызвана ошибкой внутри промоторных областей при дупликации гена, что привело к его гиперэкспрессии в кодирующей области в клетках обкладки, порождая неофункционализацию. Выбор в пользу сохранения функции фиксирования CО2, а также повышенной утилизации воды и азота при стрессовых условиях был обусловлен эволюционным давлением.
Установлено, что в ходе эволюции фермент приобрел несколько ключевых функциональных особенностей, в частности: увеличенную каталитическую активность, тетрамерную структуру и способность к pH-зависимому ингибированию собсвтенным субстратом — малатом [9]. Сайт-специфический мутагенез, вместе с разрешеним кристаллической структуры C4-НАДФ-МЭ из сорго и кукурузы позволил установить ряд аминоксилотных остатков, обеспечивающих эти функции:
- Q503, L544 и E339 увеличивают эффективность катализа;
- E339 обеспечивает pH-зависимое ингибирование малатом;
- F140 обеспечивает поддержание олигомерной структуры;
- N-конец участвует в тетрамеризации [9].
Примечания
- ↑ Kanai, Ryuzi; Edwards, Gerald E. The Biochemistry of C4 Photosynthesis // C4 Plant Biology (неопр.) / Rowan F. Sage, Russell K. Monson. — Academic Press, 1999. — С. 49—87. — ISBN 978-0-08-052839-7.
- ↑ Christopher J.T., Holtum J. Patterns of Carbon Partitioning in Leaves of Crassulacean Acid Metabolism Species during Deacidification (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 1996. — September (vol. 112, no. 1). — P. 393—399. — doi:10.1104/pp.112.1.393. — PMID 12226397.
- ↑ Furumoto T., Hata S., Izui K. cDNA cloning and characterization of maize phosphoenolpyruvate carboxykinase, a bundle sheath cell-specific enzyme (англ.) // Plant Molecular Biology : journal. — 1999. — October (vol. 41, no. 3). — P. 301—311. — doi:10.1023/A:1006317120460. — PMID 10598098.
- ↑ Rossman, Michael G.; Liljas, Anders; Brändén, Carl-Ivar; Banaszak, Leonard J. Evolutionary and Structural Relationships among Dehydrogenases // The Enzymes (неопр.) / Boyer, Paul D.. — 1975. — Т. 11. — С. 61—102. — ISBN 978-0-12-122711-1. — doi:10.1016/S1874-6047(08)60210-3.
- ↑ Bellamacina C.R. The nicotinamide dinucleotide binding motif: a comparison of nucleotide binding proteins (англ.) // The FASEB Journal[англ.] : journal. — Federation of American Societies for Experimental Biology[англ.], 1996. — September (vol. 10, no. 11). — P. 1257—1269. — PMID 8836039.
- ↑ Rothermel B.A., Nelson T. Primary structure of the maize NADP-dependent malic enzyme (англ.) // The Journal of Biological Chemistry : journal. — 1989. — November (vol. 264, no. 33). — P. 19587—19592. — PMID 2584183.
- ↑ Coleman, David E.; Rao, G. S. Jagannatha; Goldsmith, E. J.; Cook, Paul F.; Harris, Ben G. Crystal Structure of the Malic Enzyme from Ascaris suum Complexed with Nicotinamide Adenine Dinucleotide at 2.3 Å Resolution (англ.) // Biochemistry : journal. — 2002. — June (vol. 41, no. 22). — P. 6928—6938. — doi:10.1021/bi0255120. — PMID 12033925.
- ↑ Edwards G.E., Franceschi V.R., Voznesenskaya E.V. Single-cell C(4) photosynthesis versus the dual-cell (Kranz) paradigm (англ.) // Annual Review of Plant Biology : journal. — 2004. — Vol. 55. — P. 173—196. — doi:10.1146/annurev.arplant.55.031903.141725. — PMID 15377218.
- ↑ 9,0 9,1 Veronica G. Maurino, Martin J. Lercher, Maria F. Drincovich, Luitgard Nagel-Steger, Alejandro Buschiazzo. Molecular adaptations of NADP-malic enzyme for its function in C 4 photosynthesis in grasses (англ.) // Nature Plants. — 2019-06-24. — P. 1. — ISSN 2055-0278. — doi:10.1038/s41477-019-0451-7. Архивировано 20 июня 2022 года.