Гликопротеины
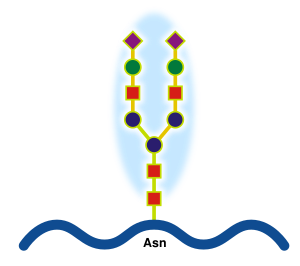
Гликопротеи́ны (устар. гликопротеиды) — двухкомпонентные белки, в которых белковая (пептидная) часть молекулы ковалентно соединена с одной или несколькими группами гетероолигосахаридов. Кроме гликопротеинов существуют также протеогликаны и гликозаминогликаны.
Гликопротеины являются важным структурным компонентом клеточных мембран животных и растительных организмов. К гликопротеинам относятся большинство белковых гормонов. Гликопротеины мембран эритроцитов, специфически гликозилированные теми или иными углеводными остатками, но имеющие гомологичную белковую часть, предопределяют группу крови у человека. Также гликопротеинами являются все антитела, интерфероны, компоненты комплемента, белки плазмы крови, молока, рецепторные белки и др.
Типы гликозилирования
Существует несколько типов гликозилирования, хотя первые два являются наиболее распространенными:
- При N-гликозилировании сахара присоединяются к азоту, обычно к амидной боковой цепи аспарагина,
- При O-гликозилировании сахара присоединяются к кислороду, обычно к серину или треонину , но также к тирозину или неканоническим аминокислотам, таким как гидроксилизин и гидроксипролин
- При P-гликозилировании сахара присоединяются к фосфору на фосфосерине
- При C-гликозилировании сахара присоединяются непосредственно к углероду, например, при добавлении маннозы к триптофану
- При S-гликозилировании бета- GlcNAc присоединяется к атому серы остатка цистеина[2]
- При гликировании , также известном как неферментативное гликозилирование, сахара ковалентно связываются с молекулой белка или липида без контролирующего действия фермента, но посредством реакции Майяра (напр. гликозилированный гемоглобин)
Моносахариды
Моносахариды, обычно встречающиеся в гликопротеинах эукариот, включают: это может быть глюкоза, фукоза, манноза, глюкозамин, галактозамин, ксилоза, сиаловые кислоты, галактоза и др.[3]:526

Те или иные моносахариды, связанные с белком, изменяют биохимические и иммунологические свойства белка, его пространственную конфигурацию и др. Важным частным случаем является связывание белков с сиаловой кислотой, приводящее к формированию сиалогликопротеинов. В типичных случаях именно связывание с сиаловой кислотой предопределяет увеличение T1/2 белка в плазме крови. В белках, которые имеют сегменты, простирающиеся вне клетки, внеклеточные сегменты также часто гликозилированы. Гликопротеины являются важными интегральными мембранными белками, где они играют роль в межклеточных взаимодействиях.
| Сахар | Тип | Сокращенное название |
|---|---|---|
| β-D-глюкоза | Гексоза | Glc |
| β-D-галактоза | Гексоза | Gal |
| β-D-манноза | Гексоза | Man |
| α-L-фукоза | Дезоксигексоза | Fuc |
| N-ацетилгалактозамин | Аминогексоза | GalNAc |
| N-ацетилглюкозамин | Аминогексоза | GlcNAc |
| N-ацетилнейраминовая кислота | Аминононулозоновая кислота (сиаловая кислота) | NeuNAc |
| Ксилоза | Пентоза | Xyl |
Примеры
Одним из примеров гликопротеинов, обнаруженных в организме, являются муцины , которые секретируются со слизью дыхательных и пищеварительных трактов. Сахара, присоединенные к муцинам, придают им значительную водоудерживающую способность, а также делают их устойчивыми к протеолизу пищеварительными ферментами. Гликопротеины важны для распознавания лейкоцитов:
- молекулы, такие как антитела (иммуноглобулины), которые напрямую взаимодействуют с антигенами
- молекулы главного комплекса гистосовместимости (или MHC), которые экспрессируются на поверхности клеток и взаимодействуют с Т-клетками как часть адаптивного иммунного ответа
- сиалиловый антиген Льюиса X на поверхности лейкоцитов
- H антиген антигенов совместимости крови ABO
Другие примеры гликопротеинов включают:
- гонадотропины (лютеинизирующий гормон фолликулостимулирующий гормон)
- гликопротеин IIb / IIIa , интегрин, обнаруженный на тромбоцитах, который необходим для нормальной агрегации тромбоцитов и прикрепления к эндотелию
- компоненты пеллюцида, который окружает яйцеклетку, и имеет важное значение для взаимодействия со сперматозоидами
- структурные гликопротеины, которые встречаются в соединительной ткани. Они помогают связывать воедино волокна, клетки и основное вещество соединительной ткани. Они также могут помочь компонентам ткани связываться с неорганическими веществами, такими как кальций в костях
- Гликопротеин-41(gp41) и гликопротеин-120 (gp120) являются белками оболочки вируса ВИЧ
- Растворимые гликопротеины часто имеют высокую вязкость, например, в яичном белке или плазме крови
- Миракулин , представляет собой гликопротеин, извлекаемый из Synsepalum dulcificum натуральный подсластитель, который изменяет способность рецепторов языка человека распознавать кислые продукты, как сладкие[5].
- Различные поверхностные гликопротеины позволяют паразиту трипаносомы сонной болезни избежать иммунного ответа хозяина.
Гормоны
Гормоны , являющиеся гликопротеинами, включают:
- Эритропоэтин (ЭПО)
- Альфа-фетопротеин
- Тиреотропный гормон
- Хорионический гонадотропин человека
- Фолликулостимулирующий гормон
- Лютеинизирующий гормон
Различие между гликопротеинами и протеогликанами
Цитата из рекомендаций ИЮПАК[6]:
Гликопротеин - это соединение, содержащее углеводы (или гликан), ковалентно связанный с белком. Углевод может быть в форме моносахарида, дисахарида(-ов). олигосахаридов, полисахаридов или их производных (например, сульфо- или фосфозамещенные). Могут присутствовать одна, несколько или много углеводных единиц. Протеогликаны представляют собой подкласс гликопротеинов, в которых углеводные единицы представляют собой полисахариды, содержащие аминосахара. Такие полисахариды также известны как гликозаминогликаны.
Функции
| Функция | Гликопротеины |
|---|---|
| Соединительная ткань и сухожилия | Коллагены |
| Смазка и защитное средство | Муцины |
| Транспортная молекула | Трансферрин , церулоплазмин |
| Иммунологическая молекула | Иммуноглобулины,[7] антигены гистосовместимости |
| Гормон | Человеческий хорионический гонадотропин (ХГЧ), тиреотропный гормон (ТТГ) |
| Фермент | Например, щелочная фосфатаза, пататин |
| Сайт распознавания прикрепления клеток | Различные белки, участвующие в межклеточной (например, сперматозоид-овоцит), вирусклеточном, бактериальноклеточном, и гормонально-клеточных взаимодействий |
| Антифриз-протеин | Некоторые белки плазмы холодноводных рыб |
| Взаимодействовать с определенными углеводами | Лектины , селектины (лектины клеточной адгезии), антитела |
| Рецептор | Различные белки, участвующие в действии гормонов и лекарств |
| Влияет на сворачивание определенных белков | Калнексин, кальретикулин |
| Регулирование развития | Notch и его аналоги, ключевые белки |
| Гемостаз (и тромбоз) | Специфические гликопротеины на поверхностных мембранах тромбоцитов |
Примечания
- ↑ (2006) «N-glycan processing in ER quality control». Journal of Cell Science 119 (21): 4373–4380. doi:10.1242/jcs.03225. PMID 17074831.
- ↑ Stepper, Judith (2011-01-18). «CysteineS-glycosylation, a new post-translational modification found in glycopeptide bacteriocins» (en). FEBS Letters 585 (4): 645–650. doi:10.1016/j.febslet.2011.01.023. ISSN 0014-5793. PMID 21251913.
- ↑ 3,0 3,1 Robert K. Murray, Daryl K. Granner & Victor W. Rodwell: "Harper's Illustrated Biochemistry 27th Ed.", McGraw–Hill, 2006
- ↑ Glycan classification Архивная копия от 27 октября 2012 на Wayback Machine SIGMA
- ↑ Theerasilp S., Kurihara Y. Complete purification and characterization of the taste-modifying protein, miraculin, from miracle fruit (англ.) // J. Biol. Chem. : journal. — 1988. — August (vol. 263, no. 23). — P. 11536—11539. — PMID 3403544. Архивировано 27 августа 2005 года.
- ↑ Nomenclature of glycoproteins, glycopeptides and peptidoglycans, Recommendations 1985. www.qmul.ac.uk. Дата обращения: 16 марта 2021. Архивировано 3 июня 2021 года.
- ↑ (2015) «Glycans in the immune system and The Altered Glycan Theory of Autoimmunity». J Autoimmun 57 (6): 1–13. doi:10.1016/j.jaut.2014.12.002. PMID 25578468.