ГАМК-оперон

ГАМК-оперон несет ответственность за превращение γ-аминобутирата (ГАМК) в сукцинат. ГАМК -оперон включает три структурных гена - gabD , gabT и gabP , которые кодируют сукцинат полуальдегида дегидрогеназы, ГАМК-трансаминазы и ГАМК-пермеазы соответственно. Существует регулирующий ген csiR, ниже оперона, который кодирует предполагаемый репрессор транскрипции[1] и активируется при ограничении азота.
ГАМК-оперон был выявлен в кишечной палочке и значимые гомологи для ферментов были обнаружены в организмах, таких как Saccharomyces cerevisiae, крысы и человека[2].
Ограничение азота — условие активации генов ГАМК. Ферменты, полученные этими генами преобразуют ГАМК в сукцинат, который затем входит в ЦТК, чтобы использоваться в качестве источника энергии. ГАМК-оперон также известен содействием гомеостазу полиаминов в течение роста при ограничении азота и поддержанию высоких концентраций внутреннего глутамата в условиях стресса. [3]
Структура
ГАМК-оперон состоит из трех структурных генов:
- gabT : кодирует ГАМК-трансаминазу, которая производит янтарный полуальдегид.
- gabD : кодирует НАДФ-зависимую дегидрогеназу янтарного полуальдегида, который окисляет янтарный полуальдегид до сукцината.
- gabP : кодирует ДНК-специфическую пермеазу.
Физиологическая значимость оперона
Ген GabT кодирует ГАМК-трансаминазу , фермент, который катализирует превращение ГАМК и 2-оксоглутарат в полуальдегид сукцината и глутамата. Полуальдегид сукцината затем окислятся в сукцинат с помощью полуальдегида дегидрогеназы сукцината (который кодируется геном gabP), тем самым вводя в ЦТК в качестве полезного источника энергии. ГАМК-оперон способствует гомеостазу полиаминов, таких как путресцин в ходе роста при ограниченнии азота. Известно также о его роли в поддержании высоких концентраций внутреннего глутамата в условиях стресса.
Регуляция
Дифференцированное регулирование промоторов
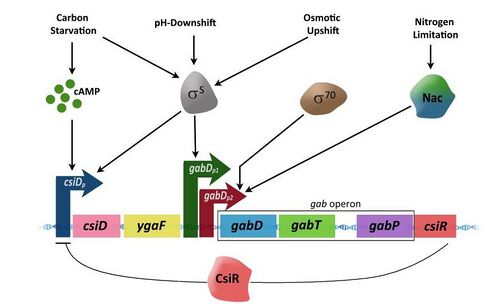
Экспрессия генов в опероне управляется тремя дифференциально регулируемыми промоторами, [4] два из которых управляются RpoS, кодирующим сигма-фактор σS.
- csiDp : — σS-зависимый и активируется исключительно углеродным голоданием, потому что действие цАМФ-CRP существенную активирует σS, содержащую РНК-полимеразу в промоторе csiD.
- gabDp1: — σ70-зависимый и индуцируется многочисленными стрессами.
- gabDp2: — σ70 зависимый и управляется Nac (управляющими усвоением азота) регуляторными белками, экспрессированными в соответствии с ограничением азота.
Механизм регулирования
Активация
Промотор csiD (csiDp) имеет важное значение для экспрессии csiD (генов, индуцированных углеродным голоданием), ygaF и ГАМК-генов. СsiDp активирован только в условиях углеродного голодания и стационарной фазы, в течение которой цАМФ накапливается в высоких концентрациях в клетке. Связывание цАМФ с белком рецептора цАМФ (CRP) вынуждает CRP жестко связываться с определенным сайтом ДНК в промоторе 'csiDp, таким образом, активируя транскрипцию генов ниже промотора.
gabDp1 оказывает дополнительное управление gabDTP в регионе. gabDp1 активирует σS вызывая условия, такие как гиперосмотические и кислые сдвиги, кроме голодания и стационарной фазы. Промотор gabDp2, с другой стороны, является σ70-зависимым и активируется при ограничении азота. В условиях ограничения азота, регулятор азота Nac связывается с участком, расположенного чуть выше промотора, экспрессирующего гены ГАМК. Гены ГАМК при активации вырабатывают ферменты, которые превращают ГАМК в сукцинат.
Репрессия
Наличие азота активирует ген csiR, расположенный ниже гена gabP . Ген csiR кодирует белок, который действует как репрессор транскрипции для csiD-ygaF-ГАМК оперонов, следовательно, отключая деградацию пути ГАМК.
Аналоги эукариот
Деградации путей ГАМК существует почти во всех эукариотических организмах и происходит под действием аналогичных ферментов. Хотя, ГАМК в кишечной палочке в основном используется в качестве альтернативного источника энергии, ГАМК в высших эукариотических организмах выступают в качестве тормозящего нейромедиатора , а также в качестве регулятора мышечного тонуса. Пути деградации ГАМК у эукариот несут ответственность за инактивацию ГАМК.
Примечания
- ↑ Schneider, Barbara L.; Ruback, Stephen; Kiupakis, Alexandros K.; Kasbarian, Hillary; Pybus, Christine; Reitzer, Larry. The Escherichia coli gabDTPC Operon: Specific γ-Aminobutyrate Catabolism and Nonspecific Induction (англ.) // Journal of Bacteriology[англ.] : journal. — 2002. — Vol. 184, no. 24. — P. 6976—6986. — doi:10.1128/JB.184.24.6976-6986.2002. — PMID 12446648.
- ↑ Bartsch, Klaus; Von Johnn-Marteville, Astrid; Schulz, Arno. Molecular Analysis of Two Genes of the Escherichia coli gab Cluster: Nucleotide Sequence of the Glutamate:Succinic Semialdehyde Transaminase Gene (gabT) and Characterization of the Succinic Semialdehyde Dehydrogenase Gene (gabD) (англ.) // Journal of Bacteriology[англ.] : journal. — 1990. — Vol. 172, no. 12. — P. 7035—7042. — PMID 2254272.
- ↑ Metzner, Martin; Germer, Jens; Hengge, Regine. Multiple stress signal integration in the regulation of the complex σS-dependent csiD-ygaF-gabDTP operon in Escherichia coli (англ.) // Molecular Microbiology : journal. — 2003. — Vol. 51, no. 3. — P. 799—811. — doi:10.1046/j.1365-2958.2003.03867.x. — PMID 14731280.
- ↑ Joloba, Moses L.; Clemmer, Katy M.; Sledjeski, Darren D.; Rather, Philip N. Activation of the gab Operon in an RpoS-Dependent Manner by Mutations That Truncate the Inner Core of Lipopolysaccharide in Escherichia coli (англ.) // Journal of Bacteriology[англ.] : journal. — 2004. — Vol. 186, no. 24. — P. 8542—8546. — doi:10.1128/JB.186.24.8542-8546.2004. — PMID 15576807.