Белки группы polycomb
Белки группы polycomb (англ. Polycomb-group proteins, PcG) — это семейство белков, которые способны ремоделировать хроматин[1]. Эти белки-регуляторы были впервые описаны у дрозофил[1], где они подавляют гомеозисные гены, контролирующие индивидуальные отличия сегментов развивающегося эмбриона[2][3][4].
Белки группы поликомб (PcG) представляют собой семейство эпигенетических регуляторов, которые, модифицируя гистоны, подавляют активность множества генов, отвечающих за клеточную дифференциацию[5][6][7]. Садясь на хроматин, чтобы вызвать локальные и глобальные изменения в хромосомной конформации, белки группы polycomb регулируют организацию их генов-мишеней в трёхмерном пространстве ядра. Влияя на 3D-архитектуру генома, они участвуют в регуляции процессов дифференциации клеток и поддержания клеточной памяти[8]. Они так видоизменяют структуру хроматина, что транскрипционные факторы не могут связываться с промоторными последовательностями ДНК[9][10].
Классификация
В организмах животных (дрозофилы, млекопитающих) и растений выявлено по меньшей мере пять типов комплексов, содержащих белки поликомб:
- ингибиторный комплекс 1 (polycomb repressive complex 1, PRC1)[11];
- ингибиторный комплекс 2 (PRC2)[12];
- ингибиторный комплекс Pho (PhoRC), содержащий ДНК-связывающие белки Pho (Pleiohomeotic) и dSfmbt (Scm-like with four mbt domains), а также, по некоторым данным, гистондеацетилазу Rpd3, шаперон гистонов NAP1, негистоновый белок HP1b, связывающий хроматин и неохарактеризованный белок CG3363[13];
- комплекс dRing (Drosophila Ring) связанных факторов (dRAF), который состоит из белков dRing/Sce (Sex combs extra), Psc (Posterior sex combs), и dKdm2 (лизин-деметилаза гистонов дрозофилы)[14][15]
- репрессорный комплекс деубиквитиназ (PR-DUB)[16].
PcG млекопитающих
У млекопитающих найдены две основные группы, содержащие комплексы белков группы polycomb — это ингибиторные комплексы 1 и 2 (PRC1 и PRC2), гены PRC1 млекопитающих значительно схожи с соответствующими генами дрозофилы. Показано, что экспрессия генов группы polycomb имеет большое значение развитии зародыша; мыши, нокаутные по обеим копиям генов PRC2, погибают на стадии зародыша, в то время как нокауты по генам PRC1 являются гомеозисными мутантами и погибают после рождения[12]. Повышение уровня экспрессии белков группы polycomb повышает инвазивность и коррелирует с более тяжелым развитием раковых опухолей.[17]
Комплекс PRC1
Комплекс PRC1 состоит из нескольких субъединиц[18][19][20]:
- Семейство субъединиц CBX, которые участвуют в механизмах поддержания баланса между самообновлением и дифференцировкой стволовых клеток:[21] (субъединицы CBX2, CBX4 и CBX8 — связываются с гистоном Н3К27me3, ингибируют экспрессию гена CBX7[19], необходимого для поддержания плюрипотентного состояния клетки и таким образом способствуют дифференцировке клеток,[22][23] в свою очередь CBX7 ингибирует синтез субъединиц CBX2, CBX4 и CBX8, необходимых для дифференцировки, и таким образом поддерживает плюрипотентное состояние клетки). Белок CBX7 (а через него и весь комплекс PRC1) связывается с гистоном H3K27me3 нуклеосомы с помощью своего хромодомена. Разработаны малые молекулы, содержащие триметиллизин, способные предотвратить образование комплекса CBX7-H3K27me3.[24] Обнаружено что субъединица CBX7 необходима для сохранения мышц и поддержания жизни в организме во время диапаузы[25].
- Bmi1 (B lymphoma Mo‑MLV insertion region 1 homolog) — необходима для пролиферации стволовых клеток.[26][27] Это связано с тем, что она подавляет экспрессию белков p16Ink4a[28] и p19Arf (оба эти белка кодируются альтернативными рамками считывания локуса Ink4a/Arf, известного также как Cdkn2a), препятствующих перепрограммированию в индуцированные плюрипотентные стволовые клетки (ИПСК). Кроме того Bmi1 может замещать транскрипционные факторы Sox2, Klf4 и c- Myc при перепрограммировании фибробластов в ИПСК.[29] Предполагается, что Bmi1 контролирует работу митохондрий и образование в них реактивных форм кислорода, способных вызвать повреждения ДНК.[30] Количество Bmi1 в клетке регулируется микроРНК-141, которая, подавляет его синтез, связываясь с его мРНК в 3'-нетранслируемой области.[31] В регуляции уровня Bmi1 в клетке участвуют факторы транскрипции семейств Myc , Myb, Twist1, SALL4, E2F1 и GLI1.[32] Поскольку Bmi1 является привлекательной терапевтической мишенью для лечения различных раковых заболеваний человека и перепрограммирования клеток сердечной мышцы, была найдена малая молекула PTC-209 специфически ингибирующая Bmi1.[32][33][34]
- PCGF1 (Polycomb group RING finger protein 1). В PRC1-подобном комплексе PCGF1-PRC1 субъединица PCGF1 необходима для инициации репрессии гена, опосредованной группой Polycomb, во время дифференцировки поскольку регулирует активность убиквитинлигазы RING1B, которая катализирует убиквитинирование Lys119 на гистоне H2A, что необходимо для привлечения PRC2 на CpG-островки.[35] Отсутствие PCGF1-PRC1 приводит к аберрантной экспрессии генов-мишеней.[36]
- PCGF2 (Polycomb group RING finger protein 2) ортолог Bmi1. Функционально не отличается от Bmi1.[37]
- PCGF6 был найден в комплексах PRC1, которые имеют H3K9-метилтрансферазу и тех, которые имеют активность H3K4-деметилаз[38]. Pcgf6 необходим для поддержания идентичности эмбриональных стволовых клеток (ЭСК). В отличие от канонической PRC1, комплексы с Pcgf6 действуют как позитивный регулятор транскрипции и связываются преимущественно с промоторами, несущими активные метки хроматина. Уровень синтеза Pcgf6 в ЭСК обычно высок и необходим для того чтобы препятствовать дифференциации, так как Pcgf6 необходим для поддержания синтеза транскипционных факторов Oct-4, Sox2 и Nanog[39].
- RYBP или его гомолог YAF2-субъединица альтернативного комплекса RYBP-PRC1,[19] который содержит RYBP, RING1B, и PCGF2/ Bmi1 и не содержит субъединиц CBX, PHC, SCM.[40] Для активации RYBP требуется подавить "созревание" микроРНК-125b, которая ингибирует RYBP. Активация RYBP приводит к RYBP-зависимому убиквитинированию H2AK119 и подавлению генов, необходимых для дифференцировки. Кроме того, RYBP требуется для посадки OCT4 на промотор Kdm2b (ген гистондеметилазы), что необходимо для успешной активации эндогенных генов плюрипотентности при перепрограммировании клеток в ИПСК.[41]
- RING1 — субъединица комплекса PRC1, которая осуществляет моноубиквитинирование гистона H2A с образованием H2A K119ub. Удаление гена Ring1B приводит к потере сразу нескольких белков PRC1, в том числе RYBP, Cbx4, PCGF2 и Bmi1[42].
- SUV39H1 (histone-lysine N-methyltransferase) — этот ядерный белок во время митоза перемещается к центромерам. Он играет важную роль в организации хроматина, разделении хромосом и в механизмах митоза, функционируя как метилтрансфераза, метилирующая лизин-9 гистона H3 с образованием Н3К9me3 — метки репрессии[43].
- L3mbtl2 — член атипичного комплекса PRC1. Он имеет важное значение для раннего эмбрионального развития. Способствует пролиферации клеток и подавляет дифференциацию. Взаимодействует с факторами плюрипотентности и аналогом PRC1 содержащим G9A, Hdac1 и Ring1b.[44]
Комплекс PRC1 ингибирует экспрессию генов и переводит хроматин в компактную форму[19][45] — гетерохроматин. С помощью субъединицы CBX он связывает «метку репрессии» — гистон Н3К27me3 в составе нуклеосомы. Кроме того, с помощью субъединицы Bmi1 комплекс связывает нуклеосомы через комплекс транскрипционных факторов Runx1/CBFβ независимо от метки Н3К27me3. С помощью субъединицы RING1, стимулируемой субъединицей Bmi1 или RYBP, PRC1 осуществляет моноубиквитинирование гистона H2A с образованием H2A K119ub, что приводит к компактизации хроматина. Кроме того с помощью субъединицы CBX7 он способствует связыванию длинных некодирующих РНК (lncRNA) c промоторными областями, что приводит к ингибированию соответствующих генов.[46][47] CBX7 в этом случае играет роль «кепирующей» шапочки, предотвращающей деградацию lncRNA с последующей «незапланированной» активацией гена.
Комплекс PRC2
Комплекс PRC2 вызывает репрессию транскрипции путём метилирования гистонов и негистоновых белков. Для его посадки на ген-мишень необходима метка активного хроматина Н3К4me3 (в образовании которой важную роль играют белки группы Trithorax) и специальная некодирующая РНК, связывающая субъединицу SUZ12.[12] Существуют две различные формы PRC2, которые помимо сердцевины состоящей из EZH1/2, SUZ12, EED, а также (RBBP4/7)[48], содержат кофакторы[49], это: PRC2.1 (содержащий один из поликомподобных белков PALI1/2) и PRC2.2 (содержащий AEBP2 и JARID2). Комплекс PRC2 имеет сложную молекулярную архитектуру[50] и состоит из нескольких субъединиц:
- Ezh1 помогает удерживать PRC2 на хроматине покоящихся клеток, в которых не идет синтез Jarid2[51].
- EZH2 (Enhancer of Zester Homolog 2) — метилтрансфераза гистонов и негистоновых белков. Ezh2 обычно присутствует в клетках, которые слабо дифференцированы и активно делятся[51]. EZH2 необходим для восстановления тканей, способствует регенеративной пролиферации прогениторных клеток. Потеря EZH2 приводит к нарушению регенерации, тогда как избыточный синтез метилтрансферазы EZH2 приводит к неопластической трансформации клетки, а мутации в её каталитическом домене приводят к лимфоме. Помочь борьбе с этими заболеваниями может GSK126, которая с высокой избирательностью ингибирует EZH2, конкурируя при этом с S-аденозил-метионином (SAM), в результате чего снижается уровень метилированных H3K27 и активируются гены-мишени, подавляемые PRC2.[52][53][54] Гистон H3 имеет несколько изоформ, одна из которых — гистон H3.3 (содержащая в позиции 31 аминокислотной последовательности треонин) присутствует только в тех местах, где гены активны, тогда как изоформа H3.1 (содержащая в позиции 31 аланин) встречается главным образом в частях генома, где нет активных генов. Это объясняется тем, что метилттрансфераза ATXR5 (Arabidopsis Trithorax-related protein 5), метилирующая лизин-27 гистона H3 (H3K27), имеет домен, который, «прочитав» треонин-31 (вместо аланина-31) в гистоне H3, ингибирует метилттрансферазную активность ATXR5. Поэтому изоформа H3.3 не может быть модифицирована меткой H3K27me1. Таким образом, участки генов, содержащих большое количество гистонов H3.3, защищены от гетерохроматизации и подавления активности во время репликации ДНК[55]
- EED (англ. embryonic ectoderm development) — субъединица комплекса PRC2, функция которой пока не вполне понятна. Предполагается что она обладает способностью связывать как с белки комплекса PRC2, так и белки комплекса PRC1. Таким образом, EED консолидирует белки комплекса PRC2 и помогает последующей посадке комплекса PRC1 на трижды метилированый локус H3K27 гена-мишени, а также повышает убиквитинлигазную активность PRC1[56]
- SUZ12 (англ. Suppressor of Zeste 12) — субъединица, связывающая короткие некодирующие РНК длиной 50-200 нуклеотидов, экспрессируемые с 5'-конца генов-мишеней polycomb в первичных T-лимфоцитах и зародышевых стволовых клетках[57]
- AEBP2 (Adipocyte Enhancer-Binding Protein) - этот белок является RBBP4/7-связывающим кофактором PRC2.2[58], регулируется промотором, расположенным на ретротранспозоне, который имеет необычный характер метилирования ДНК[59]. Предполагается, что именно благодаря регуляции субъединицей AEBP2 PRC2 предпочтительно связывает метилированную ДНК при подавлении транскрипции на хроматине[60]. Эта субъединица понижает активность метилирования и соответственно уровень гистона H3K27me3[61]
- Jarid2 (англ. jumonji, AT rich interactive domain 2) — деметилаза гистонов, один из ключевых эпигенетических регуляторов процессов развития. Jarid2, также как и Ezh2 обычно присутствует в клетках, которые слабо дифференцированы и активно делятся[51], функционирует как транскрипционный репрессор генов-мишеней. Предполагается что JARID2 взаимодействует с некодирующими РНК (lncRNA) и комплексом PRC2 и таким образом регулирует связывание PRC2 с хроматином[62][63]. Синтез Jarid2 значительно повышен в ЭСК по сравнению с дифференцированными клетками. Нокдаун этой субъединицы приводит к активации генов, связанных с дифференцировкой клетки и существенно снижает возможность перепрограммирования фибробластов в ИПСК.[64]
- Mtf2 (англ. metal response element binding transcription factor 2) известен также как PCL2 (англ. polycomb-like 2). Нокдаун гена этой субъединицы приводит к активации генов, связанных с дифференцировкой клетки, и существенно снижает возможность перепрограммирования фибробластов в ИПСК[65]
- esPRC2p48 — экспрессируется в эмбриональных стволовых клетках мыши на более высоком уровне, чем в дифференцированных клетках. Коэкспрессия генов JARID2, MTF2, и esPRC2p48 усиливает Oct4/Sox2/Klf4-опосредованное репрограммирование эмбриональных фибробластов мыши в индуцированные плюрипотентные стволовые клетки.
- Mdm2 (англ. Mouse double minute 2 homolog), физически связываясь с EZH2 на хроматине, поддерживает Polycomb-опосредованную репрессию ряда генов, способствуя повышению триметилирования гистона 3 по лизину 27 и убиквитинирования гистона 2А на лизине 119 (H2AK119). Удаление или инактивация MDM2 одновременно с H2AK119 E3 лигазой Ring1B / RNF2 останавливает пролиферацию клеток, независимо от р53[66] Митогенная роль MDM2 необходима для заживления ран при повреждении тканей. Вместе с тем MDM2 способствует воспалению тканей[67].
- PALI1 и PALI2 соответственно именуемые (англ. PRC2 associated LCOR 1) и (англ. PRC2 associated LCORL 2), белки которые присутствуют только у позвоночных животных и не встречается у беспозвоночных животных или растений. Они также отсутствуют в PRC2 комплексах содержащих AEBP2. Повышают активность метилирования и уровень гистона H3K27me3[61]
- ASXL1 (англ. Addition of sex combs-like 1), физически взаимодействует с членами PRC2 и необходим для его посадки на ДНК хроматина. Потеря или мутация ASXL1 в гемопоэтических клетках связана с глобальной потерей H3K27me3 по всему геному и в частности на локусе HOXA, что приводит к распространению мутантных клонов, а также способствует трансформации в миелоидные клетки.[68][69]
Длинные и короткие некодирующие РНК (lncRNA и miRNA)
Длинные некодирующие РНК (lncRNA) взаимодействуют с хроматином и ингибируют транскрипцию соответствующих генов, помогают комплексам PRC2 и PRC1 выбрать ген-мишень[70][71][72][73]. Обнаружено, что для lncRNA гораздо больше выражена тканевая специфичность по сравнению с кодирующими РНК, что делает их привлекательными диагностическими маркерами[74].
- Kcnq1ot1 — взаимодействует с PRC2 и PRC1, ингибирует кластер Kcnq1.[75]
- Xist — взаимодействует с PRC2, участвует в модификации гистонов Х-хромосомы[76][77] В ходе инактивации Х-хромосомы продукт Xist распределяется по эухроматиновым участкам на вблизи теломер Х-хромосомы согласно их трехмерной структуре, но не нуклеотидной последовательности[78][79][80]. Для того чтобы Xist взаимодействовала с PRC2 и посадила его на Х-хромосому необходимы белки SHARP (SMRT and HDAC associated repressor protein), который взаимодействует с SMRT корепрессором[81] и Гистондеацетилаза 3 HDAC3[82][83].
- HOTAIR — взаимодействует с PRC2 и ингибирует локус НОХ[84][85].
- ANRIL (Antisense Non-coding RNA in the INK4 Locus) — взаимодействует с PRC1 и PRC2. Вызывает ингибирование комплексом PRC1 локуса INK4b/ARF/INK4a, ответственного за подавление опухолевого роста путём активации старения клетки[86] Обнаружено, что ANRIL ускоряет развитие атеросклероза и поэтому является биомаркером и фактором риска ишемической болезни сердца.[87]
- Gtl2 (Meg3) является lncRNA, регулирующей импринтинг в локусе Dlk1-Dio3.[88] Она непосредственно связывается с PRC2. Нокдаун Gtl2 в эмбриональных стволовых клетках мыши приводит к снижению содержания Ezh2 на промоторе Dlk1 и активации экспрессии Dlk1[89]. ИПСК, у которых синтез Gtl2 подавлен, не способны к нормальной дифференцировке, о чём свидетельствует их неспособность дать начало химерным мышам и мышам, состоящим только из ИПСК[90]
- Fendrr играет важную роль в регуляторных сетях, контролирующих образование мезодермы. Она участвует в эпигенетической модификации генных промоторов. Связываясь с комплексм PRC2, она действует как модулятор хроматина, изменяющий активность соответствующих генов. В эмбрионах, у которых не хватает Fendrr, нарушается развитие стенок сердца, которое связано с резким сокращением числа PRC2 и уменьшением триметилирования H3K27 на промоторных участках.[91]
- Pint (p53-индуцированный некодирующий транскрипт) — длинная межгенная некодирующая РНК (lincRNA), регулируемая p53. Pint способствует пролиферации и выживанию клеток путём регуляции экспрессии генов путей TGF-бета, МАРК и р53. Pint является ядерной lincRNA, которая непосредственно взаимодействует с PRC2 и требуется для адресной доставки PRC2 на конкретные гены для три-метилирования H3K27, вызывающего их репрессию. Pint участвует в механизме негативной ауторегуляции p53, где lincRNA соединяет активацию р53 с эпигенетической репрессией, вызванной PRC2[92].
- lncRNA H19/miR-675 способна активировать пролиферацию клеток, подавляя синтез транскрипционного фактора RUNX1[93], а также связываясь с промотором поликомб белка EZH2[94]. Кроме того она, связывает как молекулярная губка микроРНК lethal-7 (let-7)[95], которая играет важную роль в синтезе EZH2[15] и, взаимодействуя с белком MBD1 (methyl-CpG-binding domain protein 1), участвует в поддержании репрессивных H3K9me3-гистоновых меток, необходимых для подавления сети импринтинга генов[96], что в свою очередь необходимо для контроля за уровнем экспрессии факторов роста у эмбрионов. H19 в изобилии синтезируется в эмбриональных тканях, но строго подавляется после рождения. Существенная транскрипция её сохраняется только в скелетных мышцах, где она необходима для дифференцировки сателлитных клеток в зрелые мышечные клетки и регенерации[97] .
- lncRNA FAL1 (focally amplified on chromosome 1) — онкогенная РНК, регулирующая стабильность Bmi1, что приводит к изменению транскрипции ряда генов, в том числе к ингибированию CDKN1A/p21. Репрессия синтеза FAL1 препятствует росту опухолей, но активирует старение[98]
- lncRNA MIR31HG взаимодействует с белками группы Polycomb и вместе с ними участвует в репрессии локуса INK4A в механизме, активирующем старение при онкогенезе - важном механизме подавления роста опухолей[99].
- TERRA - взаимодействует с SUZ12 комплекса PRC2 для установления и поддержания хроматина теломер в виде гетерохроматина [100],[101]. Предполагается что опосредованная TERRA посадка поликомб комплекса на гены плюрипотентности и дифференцировки регулируется компонентом комплекса шелтерин TRF1 (Telomere Repeat Binding Factor 1)[102]
Смотри также обзор[103]
Факторы транскрипции
- Транскрипционный фактор REST, известный также как NRSF (neuron-restrictive silencer factor) — ингибирует связывание PRC1 и PRC2 с участками вблизи промотора и, связываясь с субъединицей CBX, способствует независимой от метки Н3К27me3 посадке PRC1 на участки, отдаленные от промотора[104]. REST сильно коррелирует с увеличением продолжительности жизни. Уровни REST были самыми высокими в мозгах людей, которые дожили до 90 — 100 лет и при этом не заболели деменцией[105].
- Runx1/CBFβ (runt-related transcription factor 1/Core-binding factor subunit beta) - может взаимодействовать с SUV39H1 и с субъединицей Bmi1 комплекса PRC1.[106] Runx1 является фактором транскрипции, регулирующим дифференциацию гемопоэтических стволовых клеток в зрелые клетки крови. Белки Runx образуют гетеродимерный комплекс с CBFβ , что увеличивает стабильность его связи с ДНК.
- Транскрипционный фактор YY1 (Yin and Yang 1)[107] — совместно с Id1 подавляет синтез белка p16, предотвращая таким образом клеточное старение.[108] Он необходим для посадки RYBP-PRC1 на промотор.
Схема эпигенетической регуляции комплексами PRC2 и PRC1
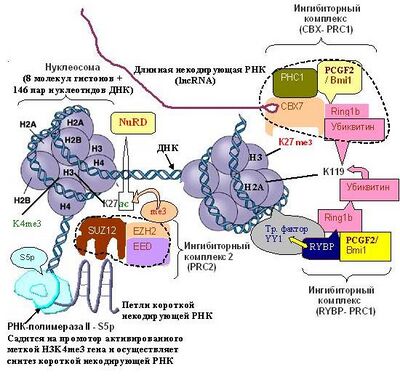
Для того чтобы комплекс PRC2 точно попал на необходимый участок гена-мишени, он должен связаться с короткой некодирующей РНК, которая транскрибируется с 5′-конца гена-мишени, подлежащего репрессии. Помогает посадке комплекса PRC2 на сайты, подлежащие репрессии, очевидно также РНК-связывающий белок RBFox2, поскольку его инактивация приводит к дерепрессии генов[109]. Транскрипцию этой РНК осуществляет РНК-полимераза II- S5p с промотора гена, активированного меткой H3K4me3. Только после того как PRC2 свяжется с этой РНК с помощью его субьединицы SUZ12, он становится способен метилировать лизин 27 гистона Н3 в составе нуклеосомы, контролирующей ген-мишень. Однако для этого лизин 27 предварительно должен быть деацетилирован комплексом NuRD[110][111]. После того как PRC2 с помощью своей субьединицы EZH2 осуществляет тройное метилирование гистона Н3 с образованием H3K27me3, в действие вступает PRC1, который связывается с нуклеосомой либо через «метку репрессии» — H3K27me3, которую узнает его субъединица CBX, либо через один из транскрипционных факторов (REST, YY1 или Runx1/CBFβ).[112] Далее PRC1 закрепляет ингибирование гена, проводя посадку убиквитина на лизин 119 гистона H2A (H2A K119ub).
Тот факт, что установка меток H3K27me3 обычно происходит в промежуток клеточного цикла, предшествующий репликации ДНК, позволяет предположить, что модификации гистонов белками Поликомб играют важную роль в сохранении эпигенетической памяти во время деления клетки[113][114][115]
Показано, что сами по себе изменения в транскрипционной активности могут регулировать модификацию H3K27me3 гистонов. Отмены транскрипции, вызванной удалением сайта начала транскрипции, достаточно, чтобы вызвать накопление H3K27me3. С другой стороны, принудительной активации транскрипции с помощью искусственного dCas9-активатора достаточно, чтобы удалить метку H3K27me3[116].
Опосредованное комплексом PRC2 триметилирование лизина 27 в гистоне H3 и связанное с ним ингибирование ряда генов являются необходимым условием перепрограммирования соматических клеток в ИПСК[6][117][118]
Бивалентные участки хроматина
Внимание многих исследователей привлекают гены, называемые бивалентными, потому что они имеют как маркеры репрессии (H3K27me3), так и маркеры активации (H3K4me3)[119][120], выполняющие роль аллостерических регуляторов[121]. Ферментом, который катализирует H3K4-триметилирование на бивалентных промоторах генов, регулирующих развитие, таких как гены Hox из эмбриональных стволовых клеток, является член семейства COMPASS, называемый Mll2 (KMT2b).[122] Маркер H3K4me3 нужен для транскрипционной активности РНК-полимеразы II — S5p, синтезирующей короткую некодирующую РНК, необходимую при посадке PRC2, тогда как H3K27me3 необходим для связывания CBX-белков комплекса PRC1. Бивалентные участки хроматина присутствуют у эмбрионов начиная со стадии 8 клеток вплоть до стадии бластоцисты, при которой клетки подразделяются на две популяции: внутренние клетки, из которых образуются эмбриональные стволовые клетки и поверхностный слой эмбриона (трофобласт). Набор генов клеток поверхностного слоя все ещё содержит бивалентные гены, однако на этих участках уже нет PRC1, хотя все ещё есть PRC2. Ключевую роль в этих клетках уже выполняют Suv39h1, которая катализирует в бивалентных генах триметилирование лизина 9 в гистоне H3 (H3K9me3)[123] и комплекс G9a/GLP, который выполняет ту же функцию но с участием комплекса PRC2[124]. Метка H3K9me3 препятствует перепрограммированию соматических клеток в индуцированные стволовые клетки, так как мешает посадке белковых репрограммирующих факторов плюрипотенции (Oct4, Sox2, Klf4, и c-Myc) на гены мишени. Инактивация ферментов, которые вызывают эту метку, значительно увеличивает темпы перепрограммирования.[125] Обнаружено, что два типа маркеров репрессии — модификации H3K9me2 и H3K27me3 — являются взаимоисключающими.[126] В процессе дифференцировки эмбриональных стволовых клеток бивалентные гены исчезают,[127] оставаясь только в менее дифференцированных клетках, таких как взрослые стволовые клетки, кроветворные (гемопоэтические) клетки и сателитные (прогениторные) клетки организма. Однако они возникают при пролиферации клеток вследствие регенерации или опухолевого роста.[128][129][130] При перепрограммировании соматических клеток в ИПСК локус Ink4a/Arf эпигенетически преобразуется в «молчащую» бивалентную форму с маркерами H3K27me3 и H3K4me3, что приводит к репрессии локуса Ink4a/Arf, который кодирует такие ингибиторы киназы клеточного цикла (CDK) как p16INK4A и p19Arf[131]. Прямо противоположный процесс наблюдается при индуцированном онкогеном RAF1 старении, когда киназа MSK1 (mitogen- and stress-activated kinase 1) осуществляет фосфорилирование серина 28 в гистоне H3K27me3, что вызывает удаление репрессорных комплексов PRC1/2 и активирует экспрессию локуса Ink4ab/Arf, приводящую к старению клетки[132].
Роль в импринтинге
Геномный импринтинг - это эпигенетический феномен, при котором гены у потомства экспрессируются моноаллельно в зависимости от того кому из родителей (отцу или матери) они принадлежали до оплодотворения. Метка H3K27me3 проставляемая комплексом PRC2 как выяснилось играет важную роль в механизмах импринтинга[133][134] В частности, потеря H3K27me3-опосредованного импринтинга понижает эффективность клонирования животных и способствует дефектам развития, наблюдаемым у клонированных эмбрионов[134][135]. Поэтому исправление H3K27me3-опосредованного импринтинга может значительно повысить эффективность клонирования[136].
Роль поликомб репрессорных комплексов в развитии и старении
На сайтах-мишенях белков SUZ12 и EED (входящих в состав репрессирующего комплекса PRC2) и на доменах бивалентного хроматина, которые контролируют экспрессию таких гомеозисных генов как HOX и PAX и другие онтогенетические гены позвоночных, как оказалось, расположены гены содержащие гиперметилированные возрастные CpG-сайты. Поэтому, и модификация H3K27me3 в нуклеосомах[137], и регуляция метилирования генов на промоторах, участвующих в развитии и старении могут представлять собой единый ключевой механизм роста и старения, отображаемый формулами универсальных эпигенетических часов для вычисления биологического возраста.[138]
Примечания
- ↑ 1,0 1,1 Lanzuolo C., Orlando V. Memories from the polycomb group proteins. (англ.) // Annual review of genetics. — 2012. — Vol. 46. — P. 561—589. — doi:10.1146/annurev-genet-110711-155603. — PMID 22994356.
- ↑ Mallo M., Alonso C. R. The regulation of Hox gene expression during animal development. (англ.) // Development (Cambridge, England). — 2013. — Vol. 140, no. 19. — P. 3951—3963. — doi:10.1242/dev.068346. — PMID 24046316.
- ↑ Lewis E. B. A gene complex controlling segmentation in Drosophila. (англ.) // Nature. — 1978. — Vol. 276, no. 5688. — P. 565—570. — PMID 103000.
- ↑ Pirrotta V. Polycombing the genome: PcG, trxG, and chromatin silencing. (англ.) // Cell. — 1998. — Vol. 93, no. 3. — P. 333—336. — PMID 9590168.
- ↑ Huang C., Xu M., Zhu B. Epigenetic inheritance mediated by histone lysine methylation: maintaining transcriptional states without the precise restoration of marks? (англ.) // Philosophical transactions of the Royal Society of London. Series B, Biological sciences. — 2013. — Vol. 368, no. 1609. — P. 20110332. — doi:10.1098/rstb.2011.0332. — PMID 23166395.
- ↑ 6,0 6,1 Fragola G., Germain P. L., Laise P., Cuomo A., Blasimme A., Gross F., Signaroldi E., Bucci G., Sommer C., Pruneri G., Mazzarol G., Bonaldi T., Mostoslavsky G., Casola S., Testa G. Cell reprogramming requires silencing of a core subset of polycomb targets. (англ.) // PLoS genetics. — 2013. — Vol. 9, no. 2. — P. e1003292. — doi:10.1371/journal.pgen.1003292. — PMID 23468641.
- ↑ Aloia L., Di Stefano B., Di Croce L. Polycomb complexes in stem cells and embryonic development. (англ.) // Development (Cambridge, England). — 2013. — Vol. 140, no. 12. — P. 2525—2534. — doi:10.1242/dev.091553. — PMID 23715546.
- ↑ Entrevan M., Schuettengruber B., Cavalli G. Regulation of Genome Architecture and Function by Polycomb Proteins. (англ.) // Trends in cell biology. — 2016. — doi:10.1016/j.tcb.2016.04.009. — PMID 27198635.
- ↑ Kirmizis A., Bartley S. M., Kuzmichev A., Margueron R., Reinberg D., Green R., Farnham P. J. Silencing of human polycomb target genes is associated with methylation of histone H3 Lys 27. (англ.) // Genes & development. — 2004. — Vol. 18, no. 13. — P. 1592—1605. — doi:10.1101/gad.1200204. — PMID 15231737.
- ↑ Portoso M and Cavalli G. The Role of RNAi and Noncoding RNAs in Polycomb Mediated Control of Gene Expression and Genomic Programming // RNA and the Regulation of Gene Expression: A Hidden Layer of Complexity (англ.). — Caister Academic Press[англ.], 2008.
- ↑ Molitor A., Shen W. H. The polycomb complex PRC1: composition and function in plants. (англ.) // Journal of genetics and genomics = Yi chuan xue bao. — 2013. — Vol. 40, no. 5. — P. 231—238. — doi:10.1016/j.jgg.2012.12.005. — PMID 23706298.
- ↑ 12,0 12,1 12,2 Margueron R., Reinberg D. The Polycomb complex PRC2 and its mark in life. (англ.) // Nature. — 2011. — Vol. 469, no. 7330. — P. 343—349. — doi:10.1038/nature09784. — PMID 21248841.
- ↑ Grimm C., Matos R., Ly-Hartig N., Steuerwald U., Lindner D., Rybin V., Müller J., Müller C. W. Molecular recognition of histone lysine methylation by the Polycomb group repressor dSfmbt. (англ.) // The EMBO journal. — 2009. — Vol. 28, no. 13. — P. 1965—1977. — doi:10.1038/emboj.2009.147. — PMID 19494831.
- ↑ Lagarou A., Mohd-Sarip A., Moshkin Y. M., Chalkley G. E., Bezstarosti K., Demmers J. A., Verrijzer C. P. dKDM2 couples histone H2A ubiquitylation to histone H3 demethylation during Polycomb group silencing. (англ.) // Genes & development. — 2008. — Vol. 22, no. 20. — P. 2799—2810. — doi:10.1101/gad.484208. — PMID 18923078.
- ↑ 15,0 15,1 Tzatsos A., Paskaleva P., Lymperi S., Contino G., Stoykova S., Chen Z., Wong K. K., Bardeesy N. Lysine-specific demethylase 2B (KDM2B)-let-7-enhancer of zester homolog 2 (EZH2) pathway regulates cell cycle progression and senescence in primary cells. (англ.) // The Journal of biological chemistry. — 2011. — Vol. 286, no. 38. — P. 33061—33069. — doi:10.1074/jbc.M111.257667. — PMID 21757686.
- ↑ Scheuermann J. C., de Ayala Alonso A. G., Oktaba K., Ly-Hartig N., McGinty R. K., Fraterman S., Wilm M., Muir T. W., Müller J. Histone H2A deubiquitinase activity of the Polycomb repressive complex PR-DUB. (англ.) // Nature. — 2010. — Vol. 465, no. 7295. — P. 243—247. — doi:10.1038/nature08966. — PMID 20436459.
- ↑ Piunti, A., & Shilatifard, A. (2021). The roles of Polycomb repressive complexes in mammalian development and cancer. Nature Reviews Molecular Cell Biology, 22(5):326-345 PMID 33723438 doi:10.1038/s41580-021-00341-1
- ↑ Gil J., O'Loghlen A. PRC1 complex diversity: where is it taking us? (англ.) // Trends in cell biology. — 2014. — Vol. 24, no. 11. — P. 632—641. — doi:10.1016/j.tcb.2014.06.005. — PMID 25065329.
- ↑ 19,0 19,1 19,2 19,3 Morey L., Aloia L., Cozzuto L., Benitah S. A., Di Croce L. RYBP and Cbx7 define specific biological functions of polycomb complexes in mouse embryonic stem cells. (англ.) // Cell reports. — 2013. — Vol. 3, no. 1. — P. 60—69. — doi:10.1016/j.celrep.2012.11.026. — PMID 23273917.
- ↑ Turner S. A., Bracken A. P. A "complex" issue: deciphering the role of variant PRC1 in ESCs. (англ.) // Cell stem cell. — 2013. — Vol. 12, no. 2. — P. 145—146. — doi:10.1016/j.stem.2013.01.014. — PMID 23395440.
- ↑ Camahort R., Cowan C. A. Cbx proteins help ESCs walk the line between self-renewal and differentiation. (англ.) // Cell stem cell. — 2012. — Vol. 10, no. 1. — P. 4—6. — doi:10.1016/j.stem.2011.12.011. — PMID 22226347.
- ↑ Morey L., Pascual G., Cozzuto L., Roma G., Wutz A., Benitah S. A., Di Croce L. Nonoverlapping functions of the Polycomb group Cbx family of proteins in embryonic stem cells. (англ.) // Cell stem cell. — 2012. — Vol. 10, no. 1. — P. 47—62. — doi:10.1016/j.stem.2011.12.006. — PMID 22226355.
- ↑ O'Loghlen A., Muñoz-Cabello A. M., Gaspar-Maia A., Wu H. A., Banito A., Kunowska N., Racek T., Pemberton H. N., Beolchi P., Lavial F., Masui O., Vermeulen M., Carroll T., Graumann J., Heard E., Dillon N., Azuara V., Snijders A. P., Peters G., Bernstein E., Gil J. MicroRNA regulation of Cbx7 mediates a switch of Polycomb orthologs during ESC differentiation. (англ.) // Cell stem cell. — 2012. — Vol. 10, no. 1. — P. 33—46. — doi:10.1016/j.stem.2011.12.004. — PMID 22226354.
- ↑ Simhadri C., Daze K. D., Douglas S. F., Quon T. T., Dev A., Gignac M. C., Peng F., Heller M., Boulanger M. J., Wulff J. E., Hof F. Chromodomain antagonists that target the polycomb-group methyllysine reader protein chromobox homolog 7 (CBX7). (англ.) // Journal of medicinal chemistry. — 2014. — Vol. 57, no. 7. — P. 2874—2883. — doi:10.1021/jm401487x. — PMID 24625057.
- ↑ Chi-Kuo Hu, Wei Wang, Julie Brind’Amour et al., (2020). Vertebrate diapause preserves organisms long term through Polycomb complex members Архивная копия от 22 февраля 2020 на Wayback Machine. Science. 367(6480), 870-874 doi:10.1126/science.aaw2601
- ↑ George Wendt, Shunsuke Nakamura, Atsushi Iwama. Crucial Role of the Polycomb Group Gene Product BMI-1 in the Maintenance of Self-Renewing Hematopoietic Stem Cells // Stem Cells and Cancer Stem Cells. — 2013. — Т. 9. — С. 143—153. — doi:10.1007/978-94-007-5645-8_14.
- ↑ Molofsky A. V., Pardal R., Iwashita T., Park I. K., Clarke M. F., Morrison S. J. Bmi-1 dependence distinguishes neural stem cell self-renewal from progenitor proliferation. (англ.) // Nature. — 2003. — Vol. 425, no. 6961. — P. 962—967. — doi:10.1038/nature02060. — PMID 14574365.
- ↑ Wang Y., Zang X., Wang Y., Chen P. High expression of p16INK4a and low expression of Bmi1 are associated with endothelial cellular senescence in the human cornea. (англ.) // Molecular vision. — 2012. — Vol. 18. — P. 803—815. — PMID 22509111.
- ↑ Moon J. H., Heo J. S., Kim J. S., Jun E. K., Lee J. H., Kim A., Kim J., Whang K. Y., Kang Y. K., Yeo S., Lim H. J., Han D. W., Kim D. W., Oh S., Yoon B. S., Schöler H. R., You S. Reprogramming fibroblasts into induced pluripotent stem cells with Bmi1. (англ.) // Cell research. — 2011. — Vol. 21, no. 9. — P. 1305—1315. — doi:10.1038/cr.2011.107. — PMID 21709693.
- ↑ Liu J., Cao L., Chen J., Song S., Lee I. H., Quijano C., Liu H., Keyvanfar K., Chen H., Cao L. Y., Ahn B. H., Kumar N. G., Rovira I. I., Xu X. L., van Lohuizen M., Motoyama N., Deng C. X., Finkel T. Bmi1 regulates mitochondrial function and the DNA damage response pathway. (англ.) // Nature. — 2009. — Vol. 459, no. 7245. — P. 387—392. — doi:10.1038/nature08040. — PMID 19404261.
- ↑ Dimri M., Carroll J. D., Cho J. H., Dimri G. P. microRNA-141 regulates BMI1 expression and induces senescence in human diploid fibroblasts. (англ.) // Cell cycle (Georgetown, Tex.). — 2013. — Vol. 12, no. 22. — P. 3537—3546. — doi:10.4161/cc.26592. — PMID 24091627.
- ↑ 32,0 32,1 Zhou, M., Xu, Q., Huang, D., & Luo, L. (2021). Regulation of gene transcription of B lymphoma Mo‑MLV insertion region 1 homolog. Biomedical Reports, 14(6), 1-8. PMID 33884195 PMC 8056379 doi:10.3892/br.2021.1428
- ↑ Yang, D., Liu, H. Q., Yang, Z., Fan, D., & Tang, Q. Z. (2021). BMI1 in the heart: Novel functions beyond tumorigenesis. EBioMedicine, 63, 103193. PMID 33421944 PMC 7804972 doi:10.1016/j.ebiom.2020.103193
- ↑ Testa, G., Russo, M., Di Benedetto, G., Barbato, M., Parisi, S., Pirozzi, F., ... & Passaro, F. (2020). Bmi1 inhibitor PTC-209 promotes Chemically-induced Direct Cardiac Reprogramming of cardiac fibroblasts into cardiomyocytes. Scientific reports, 10(1), 1-16. PMID 32346096 PMC 7189257 doi:10.1038/s41598-020-63992-8
- ↑ Riising, E. M., Comet, I., Leblanc, B., Wu, X., Johansen, J. V., & Helin, K. (2014). Gene silencing triggers polycomb repressive complex 2 recruitment to CpG islands genome wide. Molecular cell, 55(3), 347-360. PMID 24999238 doi:10.1016/j.molcel.2014.06.005
- ↑ (2021) «Variant PCGF1-PRC1 links PRC2 recruitment with differentiation-associated transcriptional inactivation at target genes». Nat Commun 12 (5341). doi:10.1038/s41467-021-24894-z.
- ↑ Ishida A., Asano H., Hasegawa M., Koseki H., Ono T., Yoshida M. C., Taniguchi M., Kanno M. Cloning and chromosome mapping of the human Mel-18 gene which encodes a DNA-binding protein with a new 'RING-finger' motif. (англ.) // Gene. — 1993. — Vol. 129, no. 2. — P. 249—255. — PMID 8325509.
- ↑ Gao Z., Zhang J., Bonasio R., Strino F., Sawai A., Parisi F., Kluger Y., Reinberg D. PCGF homologs, CBX proteins, and RYBP define functionally distinct PRC1 family complexes. (англ.) // Molecular cell. — 2012. — Vol. 45, no. 3. — P. 344—356. — doi:10.1016/j.molcel.2012.01.002. — PMID 22325352.
- ↑ Yang C. S., Chang K. Y., Dang J., Rana T. M. Polycomb Group Protein Pcgf6 Acts as a Master Regulator to Maintain Embryonic Stem Cell Identity. (англ.) // Scientific reports. — 2016. — Vol. 6. — P. 26899. — doi:10.1038/srep26899. — PMID 27247273.
- ↑ Gao Z., Zhang J., Bonasio R., Strino F., Sawai A., Parisi F., Kluger Y., Reinberg D. PCGF homologs, CBX proteins, and RYBP define functionally distinct PRC1 family complexes. (англ.) // Molecular cell. — 2012. — Vol. 45, no. 3. — P. 344—356. — doi:10.1016/j.molcel.2012.01.002. — PMID 22325352.
- ↑ Huanhuan Li, Ping Lai, Jinping Jia et al., (2017). RNA Helicase DDX5 Inhibits Reprogramming to Pluripotency by miRNA-Based Repression of RYBP and its PRC1-Dependent and -Independent Functions Архивная копия от 7 апреля 2020 на Wayback Machine. Cell Stem Cell doi:10.1016/j.stem.2016.12.002
- ↑ Hanson I. M., Poustka A., Trowsdale J. New genes in the class II region of the human major histocompatibility complex. (англ.) // Genomics. — 1991. — Vol. 10, no. 2. — P. 417—424. — PMID 1906426.
- ↑ Aagaard L., Laible G., Selenko P., Schmid M., Dorn R., Schotta G., Kuhfittig S., Wolf A., Lebersorger A., Singh P. B., Reuter G., Jenuwein T. Functional mammalian homologues of the Drosophila PEV-modifier Su(var)3-9 encode centromere-associated proteins which complex with the heterochromatin component M31. (англ.) // The EMBO journal. — 1999. — Vol. 18, no. 7. — P. 1923—1938. — doi:10.1093/emboj/18.7.1923. — PMID 10202156.
- ↑ Qin J., Whyte W. A., Anderssen E., Apostolou E., Chen H. H., Akbarian S., Bronson R. T., Hochedlinger K., Ramaswamy S., Young R. A., Hock H. The polycomb group protein L3mbtl2 assembles an atypical PRC1-family complex that is essential in pluripotent stem cells and early development. (англ.) // Cell stem cell. — 2012. — Vol. 11, no. 3. — P. 319—332. — doi:10.1016/j.stem.2012.06.002. — PMID 22770845.
- ↑ Luis N. M., Morey L., Di Croce L., Benitah S. A. Polycomb in stem cells: PRC1 branches out. (англ.) // Cell stem cell. — 2012. — Vol. 11, no. 1. — P. 16—21. — doi:10.1016/j.stem.2012.06.005. — PMID 22770239.
- ↑ Nakama M., Kawakami K., Kajitani T., Urano T., Murakami Y. DNA-RNA hybrid formation mediates RNAi-directed heterochromatin formation. (англ.) // Genes to cells : devoted to molecular & cellular mechanisms. — 2012. — Vol. 17, no. 3. — P. 218—233. — doi:10.1111/j.1365-2443.2012.01583.x. — PMID 22280061.
- ↑ Saxena A., Carninci P. Long non-coding RNA modifies chromatin: epigenetic silencing by long non-coding RNAs. (англ.) // BioEssays : news and reviews in molecular, cellular and developmental biology. — 2011. — Vol. 33, no. 11. — P. 830—839. — doi:10.1002/bies.201100084. — PMID 21915889.
- ↑ Kasinath, V., Faini, M., Poepsel, S., Reif, D., Feng, X. A., Stjepanovic, G., ... & Nogales, E. (2018). Structures of human PRC2 with its cofactors AEBP2 and JARID2. Science, 359(6378), 940-944 doi:10.1126/science.aar5700
- ↑ Moritz, L. E., & Trievel, R. C. (2017). Structure, mechanism, and regulation of polycomb repressive complex 2. Journal of Biological Chemistry, jbc-R117. doi:10.1074/jbc.R117.800367jbc.R117.800367
- ↑ Ciferri C., Lander G. C., Maiolica A., Herzog F., Aebersold R., Nogales E. Molecular architecture of human polycomb repressive complex 2. (англ.) // eLife. — 2012. — Vol. 1. — P. e00005. — doi:10.7554/eLife.00005. — PMID 23110252.
- ↑ 51,0 51,1 51,2 Son J., Shen S. S., Margueron R., Reinberg D. Nucleosome-binding activities within JARID2 and EZH1 regulate the function of PRC2 on chromatin. (англ.) // Genes & development. — 2013. — Vol. 27, no. 24. — P. 2663—2677. — doi:10.1101/gad.225888.113. — PMID 24352422.
- ↑ McCabe M. T., Ott H. M., Ganji G., Korenchuk S., Thompson C., Van Aller G. S., Liu Y., Graves A. P., Della Pietra A. 3rd, Diaz E., LaFrance L. V., Mellinger M., Duquenne C., Tian X., Kruger R. G., McHugh C. F., Brandt M., Miller W. H., Dhanak D., Verma S. K., Tummino P. J., Creasy C. L. EZH2 inhibition as a therapeutic strategy for lymphoma with EZH2-activating mutations. (англ.) // Nature. — 2012. — Vol. 492, no. 7427. — P. 108—112. — doi:10.1038/nature11606. — PMID 23051747.
- ↑ Cavalli G. Molecular biology. EZH2 goes solo. (англ.) // Science (New York, N.Y.). — 2012. — Vol. 338, no. 6113. — P. 1430—1431. — doi:10.1126/science.1232332. — PMID 23239724.
- ↑ Melnick A. Epigenetic therapy leaps ahead with specific targeting of EZH2. (англ.) // Cancer cell. — 2012. — Vol. 22, no. 5. — P. 569—570. — doi:10.1016/j.ccr.2012.10.016. — PMID 23153531.
- ↑ Jacob Y., Bergamin E., Donoghue M. T., Mongeon V., LeBlanc C., Voigt P., Underwood C. J., Brunzelle J. S., Michaels S. D., Reinberg D., Couture J. F., Martienssen R. A. Selective methylation of histone H3 variant H3.1 regulates heterochromatin replication. (англ.) // Science (New York, N.Y.). — 2014. — Vol. 343, no. 6176. — P. 1249—1253. — doi:10.1126/science.1248357. — PMID 24626927.
- ↑ Cao Q., Wang X., Zhao M., Yang R., Malik R., Qiao Y., Poliakov A., Yocum A. K., Li Y., Chen W., Cao X., Jiang X., Dahiya A., Harris C., Feng F. Y., Kalantry S., Qin Z. S., Dhanasekaran S. M., Chinnaiyan A. M. The central role of EED in the orchestration of polycomb group complexes. (англ.) // Nature communications. — 2014. — Vol. 5. — P. 3127. — doi:10.1038/ncomms4127. — PMID 24457600.
- ↑ Kanhere A., Viiri K., Araújo C. C., Rasaiyaah J., Bouwman R. D., Whyte W. A., Pereira C. F., Brookes E., Walker K., Bell G. W., Pombo A., Fisher A. G., Young R. A., Jenner R. G. Short RNAs are transcribed from repressed polycomb target genes and interact with polycomb repressive complex-2. (англ.) // Molecular cell. — 2010. — Vol. 38, no. 5. — P. 675—688. — doi:10.1016/j.molcel.2010.03.019. — PMID 20542000.
- ↑ Sun, A., Li, F., Liu, Z., Jiang, Y., Zhang, J., Wu, J., & Shi, Y. (2017). Structural and biochemical insights into human zinc finger protein AEBP2 reveals interactions with RBBP4 Архивная копия от 11 апреля 2018 на Wayback Machine. Protein & cell, 1-5. {{doi: 10.1007/s13238-017-0483-6}}
- ↑ Kim, H., Bakshi, A., & Kim, J. (2015). Retrotransposon-derived promoter of Mammalian aebp2. PloS one, 10(4), e0126966. https://doi.org/10.1371/journal.pone.0126966
- ↑ Wang, X., Paucek, R. D., Gooding, A. R., Brown, Z. Z., Eva, J. G., Muir, T. W., & Cech, T. R. (2017). Molecular analysis of PRC2 recruitment to DNA in chromatin and its inhibition by RNA. Nature Structural and Molecular Biology, 24(12), 1028-1038. doi:10.1038/nsmb.3487
- ↑ 61,0 61,1 Conway, E., Jerman, E., Healy, E., Ito, S., Holoch, D., Oliviero, G., .. & Watson, A. (2018). A Family of Vertebrate-Specific Polycombs Encoded by the LCOR/LCORL Genes Balance PRC2 Subtype Activities. Molecular Cell. doi|10.1016/j.molcel.2018.03.005
- ↑ Kaneko S., Bonasio R., Saldaña-Meyer R., Yoshida T., Son J., Nishino K., Umezawa A., Reinberg D. Interactions between JARID2 and noncoding RNAs regulate PRC2 recruitment to chromatin. (англ.) // Molecular cell. — 2014. — Vol. 53, no. 2. — P. 290—300. — doi:10.1016/j.molcel.2013.11.012. — PMID 24374312.
- ↑ Sanulli S., Justin N., Teissandier A., Ancelin K., Portoso M., Caron M., Michaud A., Lombard B., da Rocha S. T., Offer J., Loew D., Servant N., Wassef M., Burlina F., Gamblin S. J., Heard E., Margueron R. Jarid2 Methylation via the PRC2 Complex Regulates H3K27me3 Deposition during Cell Differentiation. (англ.) // Molecular cell. — 2015. — Vol. 57, no. 5. — P. 769—783. — doi:10.1016/j.molcel.2014.12.020. — PMID 25620564.
- ↑ Zhang Z., Jones A., Sun C. W., Li C., Chang C. W., Joo H. Y., Dai Q., Mysliwiec M. R., Wu L. C., Guo Y., Yang W., Liu K., Pawlik K. M., Erdjument-Bromage H., Tempst P., Lee Y., Min J., Townes T. M., Wang H. PRC2 complexes with JARID2, MTF2, and esPRC2p48 in ES cells to modulate ES cell pluripotency and somatic cell reprogramming. (англ.) // Stem cells (Dayton, Ohio). — 2011. — Vol. 29, no. 2. — P. 229—240. — doi:10.1002/stem.578. — PMID 21732481.
- ↑ Jones A., Wang H. Polycomb repressive complex 2 in embryonic stem cells: an overview. (англ.) // Protein & cell. — 2010. — Vol. 1, no. 12. — P. 1056—1062. — doi:10.1007/s13238-010-0142-7. — PMID 21213100.
- ↑ Wienken Magdalena, Dickmanns Antje, Nemajerova Alice, Kramer Daniela, Najafova Zeynab, Weiss Miriam, Karpiuk Oleksandra, Kassem Moustapha, Zhang Yanping, Lozano Guillermina, Johnsen Steven A., Moll Ute M., Zhang Xin, Dobbelstein Matthias. MDM2 Associates with Polycomb Repressor Complex 2 and Enhances Stemness-Promoting Chromatin Modifications Independent of p53 // Molecular Cell. — 2016. — Январь (т. 61, № 1). — С. 68—83. — ISSN 1097-2765. — doi:10.1016/j.molcel.2015.12.008.
- ↑ Ebrahim M., Mulay S. R., Anders H. J., Thomasova D. MDM2 beyond cancer: podoptosis, development, inflammation, and tissue regeneration. (англ.) // Histology and histopathology. — 2015. — Vol. 30, no. 11. — P. 1271—1282. — doi:10.14670/HH-11-636. — PMID 26062755.
- ↑ Abdel-Wahab, O., Adli, M., LaFave, L. M., Gao, J., Hricik, T., Shih, A. H., ... & Levine, R. L. (2012). ASXL1 mutations promote myeloid transformation through loss of PRC2-mediated gene repression. Cancer cell, 22(2), 180-193. PMID 22897849 PMC 3422511 doi:10.1016/j.ccr.2012.06.032
- ↑ Fujino, T., Goyama, S., Sugiura, Y., Inoue, D., Asada, S., Yamasaki, S., ... & Kitamura, T. (2021). Mutant ASXL1 induces age-related expansion of phenotypic hematopoietic stem cells through activation of Akt/mTOR pathway. Nature communications, 12(1), 1-20. PMID 33758188 PMC 7988019 doi:10.1038/s41467-021-22053-y
- ↑ Quinodoz Sofia, Guttman Mitchell. Long noncoding RNAs: an emerging link between gene regulation and nuclear organization // Trends in Cell Biology. — 2014. — Ноябрь (т. 24, № 11). — С. 651—663. — ISSN 0962-8924. — doi:10.1016/j.tcb.2014.08.009.
- ↑ Lee J. T. Epigenetic regulation by long noncoding RNAs. (англ.) // Science (New York, N.Y.). — 2012. — Vol. 338, no. 6113. — P. 1435—1439. — doi:10.1126/science.1231776. — PMID 23239728.
- ↑ Kornienko A. E., Guenzl P. M., Barlow D. P., Pauler F. M. Gene regulation by the act of long non-coding RNA transcription. (англ.) // BMC biology. — 2013. — Vol. 11. — P. 59. — doi:10.1186/1741-7007-11-59. — PMID 23721193.
- ↑ Long, Y., Hwang, T., Gooding, A.R. et al. RNA is essential for PRC2 chromatin occupancy and function in human pluripotent stem cells. Nat Genet (2020). https://doi.org/10.1038/s41588-020-0662-x
- ↑ Reis E. M., Verjovski-Almeida S. Perspectives of Long Non-Coding RNAs in Cancer Diagnostics. (англ.) // Frontiers in genetics. — 2012. — Vol. 3. — P. 32. — doi:10.3389/fgene.2012.00032. — PMID 22408643.
- ↑ Kanduri C. Kcnq1ot1: a chromatin regulatory RNA. (англ.) // Seminars in cell & developmental biology. — 2011. — Vol. 22, no. 4. — P. 343—350. — doi:10.1016/j.semcdb.2011.02.020. — PMID 21345374.
- ↑ Wang X. Q., Crutchley J. L., Dostie J. Shaping the Genome with Non-Coding RNAs. (англ.) // Current genomics. — 2011. — Vol. 12, no. 5. — P. 307—321. — doi:10.2174/138920211796429772. — PMID 21874119.
- ↑ Sado T., Brockdorff N. Advances in understanding chromosome silencing by the long non-coding RNA Xist. (англ.) // Philosophical transactions of the Royal Society of London. Series B, Biological sciences. — 2013. — Vol. 368, no. 1609. — P. 20110325. — doi:10.1098/rstb.2011.0325. — PMID 23166390.
- ↑ Engreitz J. M., Pandya-Jones A., McDonel P., Shishkin A., Sirokman K., Surka C., Kadri S., Xing J., Goren A., Lander E. S., Plath K., Guttman M. The Xist lncRNA exploits three-dimensional genome architecture to spread across the X chromosome. (англ.) // Science (New York, N.Y.). — 2013. — Vol. 341, no. 6147. — P. 1237973. — doi:10.1126/science.1237973. — PMID 23828888.
- ↑ НЕКОДИРУЮЩИЕ РНК ПОМОГАЮТ ИСКАТЬ РЕГУЛЯТОРНЫМ БЕЛКАМ НУЖНЫЕ ГЕНЫ. Дата обращения: 22 февраля 2020. Архивировано 22 февраля 2020 года.
- ↑ Кочанова Наталья (2013).Загадочное путешествие некодирующей РНК Xist по X-хромосоме Архивировано 19 октября 2014 года.
- ↑ Shi Y., Downes M., Xie W., Kao H. Y., Ordentlich P., Tsai C. C., Hon M., Evans R. M. Sharp, an inducible cofactor that integrates nuclear receptor repression and activation. (англ.) // Genes & development. — 2001. — Vol. 15, no. 9. — P. 1140—1151. — doi:10.1101/gad.871201. — PMID 11331609.
- ↑ McHugh C. A., Chen C. K., Chow A., Surka C. F., Tran C., McDonel P., Pandya-Jones A., Blanco M., Burghard C., Moradian A., Sweredoski M. J., Shishkin A. A., Su J., Lander E. S., Hess S., Plath K., Guttman M. The Xist lncRNA interacts directly with SHARP to silence transcription through HDAC3. (англ.) // Nature. — 2015. — Vol. 521, no. 7551. — P. 232—236. — doi:10.1038/nature14443. — PMID 25915022.
- ↑ How an RNA gene silences a whole chromosome. Архивная копия от 29 апреля 2015 на Wayback Machine. ScienceDaily, 27 April 2015
- ↑ Wutz A. RNA-mediated silencing mechanisms in mammalian cells. (англ.) // Progress in molecular biology and translational science. — 2011. — Vol. 101. — P. 351—376. — doi:10.1016/B978-0-12-387685-0.00011-1. — PMID 21507358.
- ↑ Woo C. J., Kingston R. E. HOTAIR lifts noncoding RNAs to new levels. (англ.) // Cell. — 2007. — Vol. 129, no. 7. — P. 1257—1259. — doi:10.1016/j.cell.2007.06.014. — PMID 17604716.
- ↑ Yap K. L., Li S., Muñoz-Cabello A. M., Raguz S., Zeng L., Mujtaba S., Gil J., Walsh M. J., Zhou M. M. Molecular interplay of the noncoding RNA ANRIL and methylated histone H3 lysine 27 by polycomb CBX7 in transcriptional silencing of INK4a. (англ.) // Molecular cell. — 2010. — Vol. 38, no. 5. — P. 662—674. — doi:10.1016/j.molcel.2010.03.021. — PMID 20541999.
- ↑ Chen, L., Qu, H., Guo, M., Zhang, Y., Cui, Y., Yang, Q., ... & Shi, D. (2020). ANRIL and atherosclerosis Архивная копия от 14 июня 2021 на Wayback Machine. Journal of clinical pharmacy and therapeutics, 45(2), 240-248. PMID 31703157 doi:10.1111/jcpt.13060
- ↑ Hung Ko-Hsuan, Wang Yang, Zhao Jing. Regulation of Mammalian Gene Dosage by Long Noncoding RNAs // Biomolecules. — 2013. — 4 февраля (т. 3, № 4). — С. 124—142. — ISSN 2218-273X. — doi:10.3390/biom3010124.
- ↑ Zhao J., Ohsumi T. K., Kung J. T., Ogawa Y., Grau D. J., Sarma K., Song J. J., Kingston R. E., Borowsky M., Lee J. T. Genome-wide identification of polycomb-associated RNAs by RIP-seq. (англ.) // Molecular cell. — 2010. — Vol. 40, no. 6. — P. 939—953. — doi:10.1016/j.molcel.2010.12.011. — PMID 21172659.
- ↑ Stadtfeld M., Apostolou E., Akutsu H., Fukuda A., Follett P., Natesan S., Kono T., Shioda T., Hochedlinger K. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells. (англ.) // Nature. — 2010. — Vol. 465, no. 7295. — P. 175—181. — doi:10.1038/nature09017. — PMID 20418860.
- ↑ Grote P., Wittler L., Hendrix D., Koch F., Währisch S., Beisaw A., Macura K., Bläss G., Kellis M., Werber M., Herrmann B. G. The tissue-specific lncRNA Fendrr is an essential regulator of heart and body wall development in the mouse. (англ.) // Developmental cell. — 2013. — Vol. 24, no. 2. — P. 206—214. — doi:10.1016/j.devcel.2012.12.012. — PMID 23369715.
- ↑ Marín-Béjar O., Marchese F. P., Athie A., Sánchez Y., González J., Segura V., Huang L., Moreno I., Navarro A., Monzó M., García-Foncillas J., Rinn J. L., Guo S., Huarte M. Pint lincRNA connects the p53 pathway with epigenetic silencing by the Polycomb repressive complex 2. (англ.) // Genome biology. — 2013. — Vol. 14, no. 9. — P. 104. — doi:10.1186/gb-2013-14-9-r104. — PMID 24070194.
- ↑ Zhuang M., Gao W., Xu J., Wang P., Shu Y. The long non-coding RNA H19-derived miR-675 modulates human gastric cancer cell proliferation by targeting tumor suppressor RUNX1. (англ.) // Biochemical and biophysical research communications. — 2014. — Vol. 448, no. 3. — P. 315—322. — doi:10.1016/j.bbrc.2013.12.126. — PMID 24388988.
- ↑ Luo M., Li Z., Wang W., Zeng Y., Liu Z., Qiu J. Long non-coding RNA H19 increases bladder cancer metastasis by associating with EZH2 and inhibiting E-cadherin expression. (англ.) // Cancer letters. — 2013. — Vol. 333, no. 2. — P. 213—221. — doi:10.1016/j.canlet.2013.01.033. — PMID 23354591.
- ↑ Kallen A. N., Zhou X. B., Xu J., Qiao C., Ma J., Yan L., Lu L., Liu C., Yi J. S., Zhang H., Min W., Bennett A. M., Gregory R. I., Ding Y., Huang Y. The imprinted H19 lncRNA antagonizes let-7 microRNAs. (англ.) // Molecular cell. — 2013. — Vol. 52, no. 1. — P. 101—112. — doi:10.1016/j.molcel.2013.08.027. — PMID 24055342.
- ↑ Monnier P., Martinet C., Pontis J., Stancheva I., Ait-Si-Ali S., Dandolo L. H19 lncRNA controls gene expression of the Imprinted Gene Network by recruiting MBD1. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2013. — Vol. 110, no. 51. — P. 20693—20698. — doi:10.1073/pnas.1310201110. — PMID 24297921.
- ↑ Dey B. K., Pfeifer K., Dutta A. The H19 long noncoding RNA gives rise to microRNAs miR-675-3p and miR-675-5p to promote skeletal muscle differentiation and regeneration. (англ.) // Genes & development. — 2014. — Vol. 28, no. 5. — P. 491—501. — doi:10.1101/gad.234419.113. — PMID 24532688.
- ↑ Hu X., Feng Y., Zhang D., Zhao S. D., Hu Z., Greshock J., Zhang Y., Yang L., Zhong X., Wang L. P., Jean S., Li C., Huang Q., Katsaros D., Montone K. T., Tanyi J. L., Lu Y., Boyd J., Nathanson K. L., Li H., Mills G. B., Zhang L. A functional genomic approach identifies FAL1 as an oncogenic long noncoding RNA that associates with BMI1 and represses p21 expression in cancer. (англ.) // Cancer cell. — 2014. — Vol. 26, no. 3. — P. 344—357. — doi:10.1016/j.ccr.2014.07.009. — PMID 25203321.
- ↑ Montes Marta, Nielsen Morten M., Maglieri Giulia, Jacobsen Anders, Højfeldt Jonas, Agrawal-Singh Shuchi, Hansen Klaus, Helin Kristian, van de Werken Harmen J. G., Pedersen Jakob S., Lund Anders H. The lncRNA MIR31HG regulates p16INK4A expression to modulate senescence // Nature Communications. — 2015. — 24 апреля (т. 6, № 1). — ISSN 2041-1723. — doi:10.1038/ncomms7967.
- ↑ Montero, J. J., López-Silanes, I., Megías, D., Fraga, M. F., Castells-García, Á., & Blasco, M. A. (2018). TERRA recruitment of polycomb to telomeres is essential for histone trymethylation marks at telomeric heterochromatin. Nature communications, 9(1), 1548. https://doi.org/10.1038/s41467-018-03916-3
- ↑ Bettin, N., Oss Pegorar, C., & Cusanelli, E. (2019). The emerging roles of TERRA in telomere maintenance and genome stability. Cells, 8(3), 246; https://doi.org/10.3390/cells8030246
- ↑ Marión R.M. et al., & Blasco M.A. (2019).TERRA regulate the transcriptional landscape of pluripotent cells through TRF1-dependent recruitment of PRC2. eLife 2019;8:e44656 https://doi.org/10.7554/eLife.44656.001
- ↑ Almeida, M., Bowness, J. S., & Brockdorff, N. (2020). The many faces of Polycomb regulation by RNA. Current Opinion in Genetics & Development, 61, 53-61. PMID 32403014 doi:10.1016/j.gde.2020.02.023
- ↑ Ren X., Kerppola T. K. REST interacts with Cbx proteins and regulates polycomb repressive complex 1 occupancy at RE1 elements. (англ.) // Molecular and cellular biology. — 2011. — Vol. 31, no. 10. — P. 2100—2110. — doi:10.1128/MCB.05088-11. — PMID 21402785.
- ↑ Lu T., Aron L., Zullo J., Pan Y., Kim H., Chen Y., Yang T. H., Kim H. M., Drake D., Liu X. S., Bennett D. A., Colaiácovo M. P., Yankner B. A. REST and stress resistance in ageing and Alzheimer's disease. (англ.) // Nature. — 2014. — Vol. 507, no. 7493. — P. 448—454. — doi:10.1038/nature13163. — PMID 24670762.
- ↑ Yu M., Mazor T., Huang H., Huang H. T., Kathrein K. L., Woo A. J., Chouinard C. R., Labadorf A., Akie T. E., Moran T. B., Xie H., Zacharek S., Taniuchi I., Roeder R. G., Kim C. F., Zon L. I., Fraenkel E., Cantor A. B. Direct recruitment of polycomb repressive complex 1 to chromatin by core binding transcription factors. (англ.) // Molecular cell. — 2012. — Vol. 45, no. 3. — P. 330—343. — doi:10.1016/j.molcel.2011.11.032. — PMID 22325351.
- ↑ Berk A. J. Yin and yang of mediator function revealed by human mutants. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2012. — Vol. 109, no. 48. — P. 19519—19520. — doi:10.1073/pnas.1217267109. — PMID 23184968.
- ↑ Rayess H., Wang M. B., Srivatsan E. S. Cellular senescence and tumor suppressor gene p16. (англ.) // International journal of cancer. — 2012. — Vol. 130, no. 8. — P. 1715—1725. — doi:10.1002/ijc.27316. — PMID 22025288.
- ↑ Wei C., Xiao R., Chen L., Cui H., Zhou Y., Xue Y., Hu J., Zhou B., Tsutsui T., Qiu J., Li H., Tang L., Fu X. D. RBFox2 Binds Nascent RNA to Globally Regulate Polycomb Complex 2 Targeting in Mammalian Genomes. (англ.) // Molecular cell. — 2016. — Vol. 62, no. 6. — P. 875—889. — doi:10.1016/j.molcel.2016.04.013. — PMID 27211866.
- ↑ Hu G., Wade P. A. NuRD and pluripotency: a complex balancing act. (англ.) // Cell stem cell. — 2012. — Vol. 10, no. 5. — P. 497—503. — doi:10.1016/j.stem.2012.04.011. — PMID 22560073.
- ↑ Reynolds N., Salmon-Divon M., Dvinge H., Hynes-Allen A., Balasooriya G., Leaford D., Behrens A., Bertone P., Hendrich B. NuRD-mediated deacetylation of H3K27 facilitates recruitment of Polycomb Repressive Complex 2 to direct gene repression. (англ.) // The EMBO journal. — 2012. — Vol. 31, no. 3. — P. 593—605. — doi:10.1038/emboj.2011.431. — PMID 22139358.
- ↑ Arnold P., Schöler A., Pachkov M., Balwierz P. J., Jørgensen H., Stadler M. B., van Nimwegen E., Schübeler D. Modeling of epigenome dynamics identifies transcription factors that mediate Polycomb targeting. (англ.) // Genome research. — 2013. — Vol. 23, no. 1. — P. 60—73. — doi:10.1101/gr.142661.112. — PMID 22964890.
- ↑ Lanzuolo C., Lo Sardo F., Diamantini A., Orlando V. PcG complexes set the stage for epigenetic inheritance of gene silencing in early S phase before replication. (англ.) // PLoS genetics. — 2011. — Vol. 7, no. 11. — P. e1002370. — doi:10.1371/journal.pgen.1002370. — PMID 22072989.
- ↑ Petruk S., Sedkov Y., Johnston D. M., Hodgson J. W., Black K. L., Kovermann S. K., Beck S., Canaani E., Brock H. W., Mazo A. TrxG and PcG proteins but not methylated histones remain associated with DNA through replication. (англ.) // Cell. — 2012. — Vol. 150, no. 5. — P. 922—933. — doi:10.1016/j.cell.2012.06.046. — PMID 22921915.
- ↑ Abmayr S. M., Workman J. L. Holding on through DNA replication: histone modification or modifier? (англ.) // Cell. — 2012. — Vol. 150, no. 5. — P. 875—877. — doi:10.1016/j.cell.2012.08.006. — PMID 22939615.
- ↑ Hosogane M., Funayama R., Shirota M., Nakayama K. Lack of Transcription Triggers H3K27me3 Accumulation in the Gene Body. (англ.) // Cell reports. — 2016. — doi:10.1016/j.celrep.2016.06.034. — PMID 27396330.
- ↑ Luo M., Ling T., Xie W., Sun H., Zhou Y., Zhu Q., Shen M., Zong L., Lyu G., Zhao Y., Ye T., Gu J., Tao W., Lu Z., Grummt I. NuRD blocks reprogramming of mouse somatic cells into pluripotent stem cells. (англ.) // Stem cells (Dayton, Ohio). — 2013. — Vol. 31, no. 7. — P. 1278—1286. — doi:10.1002/stem.1374. — PMID 23533168.
- ↑ Rais Y., Zviran A., Geula S., Gafni O., Chomsky E., Viukov S., Mansour A. A., Caspi I., Krupalnik V., Zerbib M., Maza I., Mor N., Baran D., Weinberger L., Jaitin D. A., Lara-Astiaso D., Blecher-Gonen R., Shipony Z., Mukamel Z., Hagai T., Gilad S., Amann-Zalcenstein D., Tanay A., Amit I., Novershtern N., Hanna J. H. Deterministic direct reprogramming of somatic cells to pluripotency. (англ.) // Nature. — 2013. — Vol. 502, no. 7469. — P. 65—70. — doi:10.1038/nature12587. — PMID 24048479.
- ↑ Voigt P., Tee W. W., Reinberg D. A double take on bivalent promoters. (англ.) // Genes & development. — 2013. — Vol. 27, no. 12. — P. 1318—1338. — doi:10.1101/gad.219626.113. — PMID 23788621.
- ↑ De Gobbi M., Garrick D., Lynch M., Vernimmen D., Hughes J. R., Goardon N., Luc S., Lower K. M., Sloane-Stanley J. A., Pina C., Soneji S., Renella R., Enver T., Taylor S., Jacobsen S. E., Vyas P., Gibbons R. J., Higgs D. R. Generation of bivalent chromatin domains during cell fate decisions. (англ.) // Epigenetics & chromatin. — 2011. — Vol. 4, no. 1. — P. 9. — doi:10.1186/1756-8935-4-9. — PMID 21645363.
- ↑ Lu C., Ward A., Bettridge J., Liu Y., Desiderio S. An autoregulatory mechanism imposes allosteric control on the V(D)J recombinase by histone H3 methylation. (англ.) // Cell reports. — 2015. — Vol. 10, no. 1. — P. 29—38. — doi:10.1016/j.celrep.2014.12.001. — PMID 25543141.
- ↑ Hu D., Garruss A. S., Gao X., Morgan M. A., Cook M., Smith E. R., Shilatifard A. The Mll2 branch of the COMPASS family regulates bivalent promoters in mouse embryonic stem cells. (англ.) // Nature structural & molecular biology. — 2013. — Vol. 20, no. 9. — P. 1093—1097. — doi:10.1038/nsmb.2653. — PMID 23934151.
- ↑ Alder O., Lavial F., Helness A., Brookes E., Pinho S., Chandrashekran A., Arnaud P., Pombo A., O'Neill L., Azuara V. Ring1B and Suv39h1 delineate distinct chromatin states at bivalent genes during early mouse lineage commitment. (англ.) // Development (Cambridge, England). — 2010. — Vol. 137, no. 15. — P. 2483—2492. — doi:10.1242/dev.048363. — PMID 20573702.
- ↑ Mozzetta C., Pontis J., Fritsch L., Robin P., Portoso M., Proux C., Margueron R., Ait-Si-Ali S. The histone H3 lysine 9 methyltransferases G9a and GLP regulate polycomb repressive complex 2-mediated gene silencing. (англ.) // Molecular cell. — 2014. — Vol. 53, no. 2. — P. 277—289. — doi:10.1016/j.molcel.2013.12.005. — PMID 24389103.
- ↑ Soufi A., Donahue G., Zaret K. S. Facilitators and impediments of the pluripotency reprogramming factors' initial engagement with the genome. (англ.) // Cell. — 2012. — Vol. 151, no. 5. — P. 994—1004. — doi:10.1016/j.cell.2012.09.045. — PMID 23159369.
- ↑ Lienert F., Mohn F., Tiwari V. K., Baubec T., Roloff T. C., Gaidatzis D., Stadler M. B., Schübeler D. Genomic prevalence of heterochromatic H3K9me2 and transcription do not discriminate pluripotent from terminally differentiated cells. (англ.) // PLoS genetics. — 2011. — Vol. 7, no. 6. — P. e1002090. — doi:10.1371/journal.pgen.1002090. — PMID 21655081.
- ↑ Aldiri I., Vetter M. L. PRC2 during vertebrate organogenesis: a complex in transition. (англ.) // Developmental biology. — 2012. — Vol. 367, no. 2. — P. 91—99. — doi:10.1016/j.ydbio.2012.04.030. — PMID 22565092.
- ↑ Mallen-St Clair J., Soydaner-Azeloglu R., Lee K. E., Taylor L., Livanos A., Pylayeva-Gupta Y., Miller G., Margueron R., Reinberg D., Bar-Sagi D. EZH2 couples pancreatic regeneration to neoplastic progression. (англ.) // Genes & development. — 2012. — Vol. 26, no. 5. — P. 439—444. — doi:10.1101/gad.181800.111. — PMID 22391448.
- ↑ Richly H, Aloia L, Di Croce L. Roles of the Polycomb group proteins in stem cells and cancer // Cell Death & Disease. — 2011. — Сентябрь (т. 2, № 9). — С. e204—e204. — ISSN 2041-4889. — doi:10.1038/cddis.2011.84.
- ↑ Zheng Y., He L., Wan Y., Song J. H3K9me-enhanced DNA hypermethylation of the p16INK4a gene: an epigenetic signature for spontaneous transformation of rat mesenchymal stem cells. (англ.) // Stem cells and development. — 2013. — Vol. 22, no. 2. — P. 256—267. — doi:10.1089/scd.2012.0172. — PMID 22873822.
- ↑ Ding X., Wang X., Sontag S., Qin J., Wanek P., Lin Q., Zenke M. The polycomb protein Ezh2 impacts on induced pluripotent stem cell generation. (англ.) // Stem cells and development. — 2014. — Vol. 23, no. 9. — P. 931—940. — doi:10.1089/scd.2013.0267. — PMID 24325319.
- ↑ Culerrier R., Carraz M., Mann C., Djabali M. MSK1 triggers the expression of the INK4AB/ARF locus in oncogene-induced senescence. (англ.) // Molecular biology of the cell. — 2016. — Vol. 27, no. 17. — P. 2726—2734. — doi:10.1091/mbc.E15-11-0772. — PMID 27385346.
- ↑ Chen, Z., Yin, Q., Inoue, A., Zhang, C., & Zhang, Y. (2019). Allelic H3K27me3 to allelic DNA methylation switch maintains noncanonical imprinting in extraembryonic cells. Science Advances, 5(12), eaay7246. doi:10.1126/sciadv.aay7246 PMC 6989337
- ↑ 134,0 134,1 Chen, Z., & Zhang, Y. (2020). Maternal H3K27me3-dependent autosomal and X chromosome imprinting. Nature Reviews Genetics, 1-17. doi:10.1038/s41576-020-0245-9 PMID 32514155
- ↑ Matoba, S., Wang, H., Jiang, L., Lu, F., Iwabuchi, K. A., Wu, X., ... & Ogura, A. (2018). Loss of H3K27me3 imprinting in somatic cell nuclear transfer embryos disrupts post-implantation development. Cell stem cell, 23(3), 343-354. doi:10.1016/j.stem.2018.06.008 PMC 6326833
- ↑ Overcoming Genomic Imprinting Barrier Improves Mammal Cloning. Дата обращения: 20 июня 2020. Архивировано 20 июня 2020 года.
- ↑ Das, P., & Taube, J. H. (2020). Regulating Methylation at H3K27: A Trick or Treat for Cancer Cell Plasticity. Cancers, 12(10), 2792. PMID 33003334 PMC 7600873 doi:10.3390/cancers12102792
- ↑ Ake T. Lu, Zhe Fei, Amin Haghani, Todd R. Robeck et al., & Steve Horvath (2021). Universal DNA methylation age across mammalian tissues Архивная копия от 21 января 2021 на Wayback Machine. biorxiv.org doi:10.1101/2021.01.18.426733
Литература
- Guido van Mierlo, Gert Jan C. Veenstra, Michiel Vermeulen, Hendrik Marks (2019). The Complexity of PRC2 Subcomplexes. Trends in Cell Biology, DOI: https://doi.org/10.1016/j.tcb.2019.05.004
- Laugesen A., Højfeldt J. W., Helin K. (2019). Molecular Mechanisms Directing PRC2 Recruitment and H3K27 Methylation. Molecular Cell, 74(1), 8-18, DOI:https://doi.org/10.1016/j.molcel.2019.03.011
- Vidal, M. (2014). Polycomb Complexes: Chromatin Regulators Required for Cell Diversity and Tissue Homeostasis. In Transcriptional and Epigenetic Mechanisms Regulating Normal and Aberrant Blood Cell Development (pp. 95–139). Springer Berlin Heidelberg. doi:10.1007/978-3-642-45198-0_5 Online ISBN 978-3-642-45198-0
- Marianne Entrevan, Bernd Schuettengruber, Giacomo Cavalli (2016). Regulation of Genome Architecture and Function by Polycomb Proteins. Trends in Cell Biology, 26(7), 511–525 doi:10.1016/j.tcb.2016.04.009
- Comet, I., & Helin, K. (2014). Revolution in the Polycomb hierarchy. Nature structural & molecular biology, 21(7), 573-575. doi:10.1038/nsmb.2848
- Schwartz, Y. B., & Pirrotta, V. (2014). Ruled by Ubiquitylation: A New Order for Polycomb Recruitment. Cell reports, 8(2), 321-325. doi:10.1016/j.celrep.2014.07.001
- Nathan R. Rose, Robert J. Klose, (2014).Understanding the relationship between DNA methylation and histone lysine methylation. Biochimica et Biophysica Acta (BBA) — Gene Regulatory Mechanisms doi:10.1016/j.bbagrm.2014.02.007
- Gozani, O., & Shi, Y. (2014). Histone Methylation in Chromatin Signaling. In: Fundamentals of Chromatin (pp. 213–256). Springer New York. doi: 10.1007/978-1-4614-8624-4_5
- Jeffrey A. Simon, Robert E. Kingston (2013) Occupying Chromatin: Polycomb Mechanisms for Getting to Genomic Targets, Stopping Transcriptional Traffic, and Staying Put. Molecular Cell, 49(5), 808—824 https://dx.doi.org/10.1016/j.molcel.2013.02.013
- Bernd Schuettengruber, Henri-Marc Bourbon, Luciano Di Croce, Giacomo Cavalli (2017). Genome Regulation by Polycomb and Trithorax: 70 Years and Counting. Cell, 171(1), 34–57, DOI: https://dx.doi.org/10.1016/j.cell.2017.08.002
- Di Croce, L., & Helin, K. (2013) Transcriptional regulation by Polycomb group proteins. Nature structural & molecular biology, 20(10), 1147—1155. doi:10.1038/nsmb.2669
- Olsen, J. B., Greenblatt, J., & Emili, A. (2014). Histone Methyltransferase Complexes in Transcription, Development, and Cancer. In Systems Analysis of Chromatin-Related Protein Complexes in Cancer (pp. 33–47). Springer New York. doi: 10.1007/978-1-4614-7931-4_2
- Shahram Golbabapour, Nazia Abdul Majid, Pouya Hassandarvish, Maryam Hajrezaie, Mahmood Ameen Abdulla, and A. Hamid A. Hadi. (June 2013). Gene Silencing and Polycomb Group Proteins: An Overview of their Structure, Mechanisms and Phylogenetics. OMICS: A Journal of Integrative Biology, 17(6): 283—296. doi:10.1089/omi.2012.0105
- Anne Laugesen , Kristian Helin (June 2014). Chromatin Repressive Complexes in Stem Cells, Development, and Cancer. Cell Stem Cell, 14(6), 735—751 doi:10.1016/j.stem.2014.05.006
- Jesús Gi, Ana O’Loghlenemai (2014). PRC1 complex diversity: where is it taking us? doi:10.1016/j.tcb.2014.06.005
- John W Whitaker, Zhao Chen & Wei Wang(2014). Predicting the human epigenome from DNA motifs. Nature Methods doi:10.1038/nmeth.3065
- Beatrice Bodega, Chiara Lanzuolo (2016). Polycomb Group Proteins: Methods and ProtocolsПодробные, легко воспроизводимые лабораторные протоколы, а также советы как избежать известных ошибок.
- Filippo Ciabrelli, Federico Comoglio, Simon Fellous, Boyan Bonev, Maria Ninova, Quentin Szabo, Anne Xuéreb, Christophe Klopp, Alexei Aravin, Renato Paro, Frédéric Bantignies, Giacomo Cavalli (2017). Stable Polycomb-dependent transgenerational inheritance of chromatin states in Drosophila. Nature Genetics,; doi:10.1038/ng.3848
- Takahiro Ito, Yee Voan Teo, Shane A. Evans, Nicola Neretti, John M. Sedivy (2018). Regulation of Cellular Senescence by Polycomb Chromatin Modifiers through Distinct DNA Damage- and Histone Methylation-Dependent Pathways Cell Reports, 22(13), 3480–3492 doi:10.1016/j.celrep.2018.03.002
- Skourti-Stathaki, K., Triglia, E. T., Warburton, M., Voigt, P., Bird, A., & Pombo, A. (2019). R-Loops Enhance Polycomb Repression at a Subset of Developmental Regulator Genes. Molecular cell. 73(5), 930-945.E4
- Ren, X., Hu, B., Song, M., Ding, Z., Dang, Y., Liu, Z., ... & Chan, P. (2019). Maintenance of Nucleolar Homeostasis by CBX4 Alleviates Senescence and Osteoarthritis. Cell reports, 26(13), 3643-3656. doi:10.1016/j.celrep.2019.02.088
- Zhou, C., Wang, Y., Zhang, J., Su, J., An, Q., Liu, X., ... & Zhang, Y. (2019). H3K27me3 is an epigenetic barrier while KDM6A overexpression improves nuclear reprogramming efficiency. The FASEB Journal, 33(3), 4638-4652. PMID 30673507 doi:10.1096/fj.201801887R
- Lee, S., Lee, C., Hwang, C. Y., Kim, D., Han, Y., Hong, S. N., ... & Cho, K. H. (2020). Network inference analysis identifies SETDB1 as a key regulator for reverting colorectal cancer cells into differentiated normal-like cells. Molecular Cancer Research, 18(1), 118-129. PMID 31896605 doi:10.1158/1541-7786.MCR-19-0450
- Fukuda, K., & Shinkai, Y. (2020). SETDB1-Mediated silencing of retroelements. Viruses, 12(6), 596. PMID 32486217 PMC 7354471 doi:10.3390/v12060596
- Strepkos, D., Markouli, M., Klonou, A., Papavassiliou, A. G., & Piperi, C. (2021). Histone methyltransferase SETDB1: A common denominator of tumorigenesis with therapeutic potential. Cancer Research, 81(3), 525-534. PMID 33115801 doi:10.1158/0008-5472.CAN-20-2906
- Kalashnikova, D. A., Maksimov, D. A., Romanov, S. E., Laktionov, P. P., & Koryakov, D. E. (2021). SetDB1 and Su (var) 3-9 play non-overlapping roles in somatic cell chromosomes of Drosophila melanogaster. Journal of cell science, 134(2), jcs253096. PMID 33288549 doi:10.1242/jcs.253096
Белок эухроматина гистон H3 лизин 9-специфическая метилтрансфераза SetDB1 связывается с хроматином вне доменов, обладающих модификацией H3K27me3, отсутствует на компартментах повторяющихся ДНК и способствует стабильности генома подавляя активность ретроэлементов. SetDB1 присутствует на сайтах начала транскрипции и на 5'-нетранслируемых областях многих экспрессируемых генов. Истощение SETDB1 эффективно превращает стволовые клетки колоректального рака в постмитотические клетки и восстанавливает нормальную морфологию органоидов колоректального рака, полученных от пациентов.
- Collier, A. J., Bendall, A., Fabian, C., et al., & Rugg-Gunn, P. J. (2022). Genome-wide screening identifies Polycomb repressive complex 1.3 as an essential regulator of human naïve pluripotent cell reprogramming. Science Advances, 8(12), eabk0013. PMID 35333572 doi:10.1126/sciadv.abk0013
- Zhu, Y., Dong, L., Wang, C., Hao, K., Wang, J., Zhao, L., ... & Qin, J. (2022). Functional redundancy among Polycomb complexes in maintaining the pluripotent state of embryonic stem cells. Stem Cell Reports. https://doi.org/10.1016/j.stemcr.2022.02.020