Альтернативный сплайсинг

Альтернати́вный спла́йсинг — вариант сплайсинга матричных РНК (мРНК), при котором в ходе экспрессии гена на основе одного и того же первичного транскрипта (пре-мРНК) происходит образование нескольких зрелых мРНК. Структурные и функциональные различия образовавшихся транскриптов могут быть вызваны как выборочным включением в зрелую мРНК экзонов первичного транскрипта, так и сохранением в ней частей интронов[1][2]. Наиболее распространённая разновидность альтернативного сплайсинга предусматривает пропуск экзона[англ.]: отдельные экзоны транскрипта при определённых условиях могут быть как включены в зрелую мРНК, так и пропущены[3].
Белки, получаемые трансляцией таких мРНК, в результате имеют разные аминокислотные последовательности; таким образом, при альтернативном сплайсинге один транскрипт обеспечивает синтез нескольких белков. Широкое распространение такого сплайсинга у эукариот приводит к значительному увеличению разнообразия белков, закодированных в их геномах[4]. Например, организм человека синтезирует не менее чем 100 тысяч различных белков, в то время как число кодирующих их генов примерно 20 тысяч (при этом среди всех генов человека, которые содержат интроны, более 75 % выступают как матрицы для синтеза пре-мРНК, подвергаемых далее альтернативному сплайсингу)[1][2].
Образование альтернативно сплайсированных мРНК находится под контролем системы транс-действующих белков (факторов сплайсинга[англ.]), которые связываются с цис-сайтами первичного транскрипта. Среди факторов сплайсинга выделяют активаторы и репрессоры сплайсинга: первые способствуют использованию отдельных его сайтов, а вторые, наоборот, предотвращают их использование. Механизмы альтернативного сплайсинга очень разнообразны, знание «кода сплайсинга» создаёт возможность предсказывать результаты сплайсинга конкретного гена в тех или иных условиях[5][6].
Аномалии альтернативного сплайсинга нередко приводят к болезням; немало генетических заболеваний человека вызвано этими аномалиями[5]. Исследователи полагают, что аберрантный сплайсинг может способствовать развитию рака, причём показано, что при различных видах рака гены факторов сплайсинга часто мутируют, приводя к нарушению нормального хода сплайсинга[7][8][9][10]. Установлено также, что аномалии альтернативного сплайсинга вносят вклад в развитие резистентности организма к химиотерапии[11].
История изучения
Впервые альтернативный сплайсинг был описан в 1977 году у аденовирусов[12][13]. Было установлено, что аденовирус образует пять различных транскриптов в ранней стадии инфекционного цикла, до репликации вирусной ДНК, и ещё один после начала репликации ДНК; при этом образование ранних первичных транскриптов продолжается после начала репликации ДНК. Дополнительный одиночный транскрипт, образуемый на поздних стадиях инфекционного цикла, считывается с 5/6 аденовирусного генома размером 32 килобазы. Поздний транскрипт гораздо длиннее каждого из ранних вирусных транскриптов. Исследователи показали, что первичный транскрипт, образуемый аденовирусом типа 2 на поздних стадиях инфекции, подвергается сплайсингу разными способами, что приводит к образованию мРНК, кодирующих разные вирусные белки. Кроме того, первичный транскрипт содержит множество сайтов полиаденилирования, в результате чего у разных мРНК могут получаться разные 3'-концы[14][15][16].
В 1981 году альтернативный сплайсинг был описан у клеточного эукариотического гена. Было показано, что в клетках млекопитающих такой альтернативный сопровождает образование гормона кальцитонина. Первичный транскрипт гена кальцитонина содержит 6 экзонов; в зрелую мРНК, кодирующую кальцитонин, входят экзоны 1—4, и сигнал полиаденилирования находится в экзоне 4. У другой мРНК, образуемой из того же первичного транскрипта, при сплайсинге экзон 4 пропускается, и зрелая мРНК содержит экзоны 1—3, 5 и 6. Она кодирует белок, известный как Кальцитонин ген-родственный пептид[англ.] (англ. calcitonin gene related peptide)[17][18]. В начале 1980-х годов был также открыт альтернативный сплайсинг в генах иммуноглобулинов млекопитающих[14][19].
Последующие исследования показали, что альтернативный сплайсинг распространён среди всех эукариот[3]. При этом количество изоформ белка, которые могут быть транслированы с одного гена, может быть весьма значительным. Так, подсчитано, что ген плодовой мушки Drosophila melanogaster, известный как DSCAM[англ.], при независимом комбинировании в мРНК всех имеющихся экзонов потенциально может обеспечить синтез 38 016 изоформ[20].
Модели
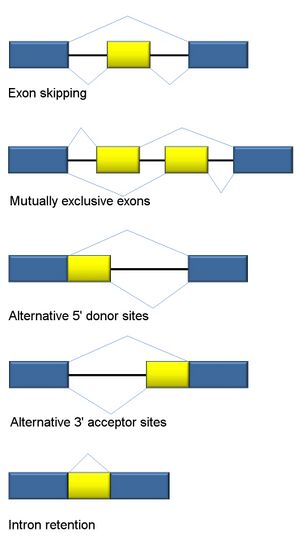

Существует пять моделей альтернативного сплайсинга[3][4][5][21][22]:
- Пропуск экзона или кассетный экзон. В данном случае любой экзон может быть вырезан или включён в состав зрелой мРНК. Это — наиболее распространённая модель прохождения альтернативного сплайсинга у пре-мРНК млекопитающих, по некоторым подсчётам, более 38 % событий альтернативного сплайсинга у млекопитающих следует данной модели[23]).
- Взаимоисключающие экзоны. Из двух экзонов в зрелую мРНК включается только один, но не оба (данная модель сложнее остальных, поскольку предусматривает скоординированное протекание, по крайней мере, двух событий альтернативного сплайсинга[23]).
- Альтернативный донорный сайт. Используется альтернативный 5'-конец интрона (донорный сайт), так что меняется 3'-конец вышестоящего экзона (у млекопитающих данный механизм ответственен примерно за 8 % событий альтернативного сплайсинга[23]).
- Альтернативный акцепторный сайт. Используется альтернативный 3'-конец интрона (акцепторный сайт), так что меняется 5'-конец нижестоящего экзона (на этой модели основано примерно 18 % событий альтернативного сплайсинга у млекопитающих[23]).
- Удержание интрона. Последовательность может быть вырезана как интрон или оставлена в зрелой мРНК. Этот способ отличается от пропуска экзона, поскольку сохраняемая последовательность не окружена интронами. Если оставленный интрон попадает в кодирующую область, то он должен кодировать аминокислотную последовательность с такой же рамкой считывания, как и соседние экзоны. Если же он будет иметь другую рамку считывания или содержать стоп-кодон, белок будет нефункциональным. Это — самый редкий механизм альтернативного сплайсинга у млекопитающих (на него приходится примерно 3 % событий АС; в то же время, данный механизм достаточно широко распространён при онкологических заболеваниях, где он служит одним из механизмов инактивации генов-супрессоров опухолей[23])[21].
Кроме пяти основных моделей альтернативного сплайсинга, известны два способа получения нескольких белков с одного гена в результате использования множественных промоторов и множественных сайтов полиаденилирования. Однако, использование множественных промоторов относится, скорее, к регуляции транскрипции, чем к альтернативному сплайсингу. Начиная транскрипцию с разных точек, можно получить транскрипты с различающимися 5'-концевыми экзонами. С другой стороны, использование множественных сайтов полиаденилирования приводит к образованию разных 3'-концов у созревающих транскриптов. Оба этих механизма в сочетании с пятью моделями сплайсинга обеспечивают разнообразие мРНК, считываемых с одного и того же гена[3][5].

Один транскрипт способен подвергаться более чем одному типу альтернативного сплайсинга[22]. Рассмотренные выше модели хорошо описывают базовые механизмы сплайсинга, однако могут не подходить для сложных случаев. Например, на рисунке справа представлены три формы гена гиалуронидазы 3 мыши, полученные в ходе сплайсинга. Сравнение экзонов первой формы (зелёная) и второй (жёлтая) указывает, что интрон был сохранён в конечном транскрипте, а сравнение второй формы с третьей (синяя) показывает пропуск экзона[21].
Механизм
Общая схема сплайсинга

Пре-мРНК, транскрибируемая с ДНК, содержит как экзоны, так и интроны, причём число и длина интронов, создающих необходимый фон для альтернативного сплайсинга, у различных эукариот существенно варьирует. Так, среднее число интронов, приходящееся на один интрон-содержащий ген, у модельных организмов составляет: у дрозофилы Drosophila melanogaster — 2,5, у нематоды Caenorhabditis elegans — 4,2, у резуховидки Таля Arabidopsis thaliana — 4,8; у млекопитающих оно изменяется от 5,7 до 7,8[24]. В ходе сплайсинга экзоны должны быть оставлены в транскрипте, а интроны удалены. Регуляцию и выбор сайтов сплайсинга обеспечивают транс-действующие белки-активаторы и репрессоры сплайсинга, а также присутствующие в самой пре-мРНК цис-действующие элементы — энхансеры и сайленсеры сплайсинга[25].
Типичные эукариотические интроны содержат консенсусные последовательности; так, на 5'-конце каждого интрона присутствует динуклеотид GU, рядом с 3'-концом находится «точка ветвления», в которой всегда присутствует нуклеотид А, а расположенные вокруг него последовательности варьируются. У человека консенсусная последовательность вокруг точки ветвления yUnAy[26]. После точки ветвления расположен ряд пиримидинов (полипиримидиновый тракт[англ.]), а 3'-конец интрона выглядит как AG[5].
Сплайсинг пре-мРНК осуществляет РНК-белковый комплекс, известный как сплайсосома. В состав сплайсосомы входят малые ядерные рибонуклеопротеиды[англ.] (snRNP), обозначаемые U1[англ.], U2[англ.], U4[англ.], U5[англ.] и U6[англ.] (рибонуклеотид U3 в сплайсинге мРНК не участвует)[23][27]. Рибонуклеотид U1 связывается с 5'-концевым динуклеотидом GU, а U2, при участии белковых факторов U2AF, связывается с точкой ветвления (на этой стадии комплекс называется сплайсосомный А-комплекс). Во время формирования А-комплекса определяются 5'- и 3'-границы удаляемого интрона, а также концы экзонов, которые должны быть оставлены[5] .
Далее с А-комплексом связывается комплекс U4, U5, U6. После этого U6 замещает U1, а U1 и U4 покидают комплекс. Оставшийся комплекс подвергается двум реакциям переэтерификации. В ходе первой реакции происходит отрезание 5'-конца интрона от вышележащего экзона и его присоединение в точке ветвления к нуклеотиду А с помощью 2',5'-фосфодиэфирной связи, в результате чего интрон принимает форму лассо. Вторая реакция обеспечивает отрезание 3'-конца интрона и соединение двух экзонов фосфодиэфирной связью; при этом интрон высвобождается и разрушается[3][23].
Регуляторные элементы и белки

Сплайсинг регулируется транс-действующими белками (активаторами и репрессорами) и соответствующими цис-регуляторными элементами (сайленсерами и энхансерами) на пре-мРНК. Впрочем, имеются данные, что во многих случаях действие фактора сплайсинга зависит от его положения: когда фактор сплайсинга связан с интронным энхансерным элементом, он действует как активатор сплайсинга, а когда связывается с регуляторным сайтом в экзоне, то действует как репрессор[25]. В регуляции сплайсинга принимает также участие вторичная структура пре-мРНК, которая обеспечивает эффективное сближение друг с другом двух регуляторных элементов или маскирует те последовательности, которые могли бы служить местами связывания факторов сплайсинга[28][29]. Вместе все эти элементы образуют «код сплайсинга», который определяет, как будет проходить сплайсинг в данных клеточных условиях[30][31].
Известны два типа цис-активирующих элементов в пре-мРНК, и им соответствуют транс-активирующие РНК-связывающие белки. Сайленсеры сплайсинга — это элементы, с которыми связываются белки-репрессоры сайленсинга, снижая при этом вероятность того, что по соседству будет находиться сайт сплайсинга. Местом размещения сайленсеров сплайсинга могут быть как интроны (интронные сайленсеры сплайсинга, ISS), так и экзоны (экзонные сайленсеры сплайсинга, ESS). Их нуклеотидные последовательности, как и связывающиеся с ними белки, весьма разнообразны. Большинство репрессоров сплайсинга являются гетерогенными ядерными рибонуклеопротеидами[англ.] (hnRNP) — такими, как hnRNPA1[англ.] и белок, связывающий полипиримидиновый тракт (PTB)[5][30].
С энхансерами сплайсинга связываются белки-активаторы сплайсинга, увеличивая эффективную вероятность того, что рядом будет находиться сайт сплайсинга. Их местом размещения также могут служить как интроны (интронные энхансеры сплайсинга, ISE), так и экзоны (экзонные энхансеры сплайсинга, ESE). Бо́льшая часть белков, связывающихся с ISE и ESE, относится к семейству белков SR[англ.] (регулирующим не только ход альтернативного сплайсинга, но и многие другие клеточные процессы[32]; первый из белков данного семейства, идентифицированный как фактор сплайсинга, был открыт в 1991 году[33]). Эти белки содержат мотивы, распознающие РНК, а также домены, обогащённые аргинином и серином[5][30].

Таким образом, факторы сплайсинга действуют взаимозависимо, причём результаты их действия зависят также от окружения[31]. Наличие определённых цис-регуляторных последовательностей РНК способно как увеличить вероятность того, что рядом будет находиться сайт сплайсинга, так и уменьшить эту вероятность — в зависимости от контекста. Например, некоторые такие элементы влияют на сплайсинг только при наличии рядом с ними других вполне определённых элементов. Кроме того, цис-регуляторные элементы могут давать разный эффект при экспрессии в клетке определённых белков. Адаптивное значение энхансеров и сайленсеров сплайсинга подтверждают работы, показывающие, что в человеческих генах мутации, приводящие к образованию новых сайленсеров или разрушению старых энхансеров, подвержены строгому отбору[34][35].
Примеры
Пропуск экзона: ген dsx дрозофилы

Пре-мРНК гена dsx[англ.] дрозофилы D. melanogaster содержит 6 экзонов. У самцов в зрелую мРНК входят экзоны 1, 2, 3, 5, 6, и они кодируют белок, который функционирует как регулятор транскрипции в развитии по мужскому типу. У самок в зрелую мРНК входят экзоны 1, 2, 3 и 4, причём экзон 4 содержит сигнал полиаденилирования, по которому мРНК разрезается. Получившийся белок функционирует как регулятор транскрипции в развитии по женскому типу[36].
В описанном примере имеет место альтернативный сплайсинг по типу пропуска экзона. Интрон, лежащий выше экзона 4, содержит полипиримидиновый тракт, который не вполне удовлетворяет консенсусной последовательности сплайсинга, поэтому белки U2AF в отсутствие активаторов сплайсинга связываются с ним плохо. По этой причине у самцов этот 3'-акцепторный сайт сплайсинга не используется. У самок, однако, присутствует активатор сплайсинга Transformer (Tra). Этот белок связывается с SR-белком Tra2 (который образуется у обоих полов и связывается с ESE в экзоне 4) и совместно с ещё одним SR-белком, dsxRE, формирует комплекс, который содействует связыванию белков U2AF со слабым пиримидиновым трактом. U2 рекрутируется к соответствующей точке ветвления, и в результате происходит включение экзона 4 в состав зрелой мРНК[36][37].
Альтернативные акцепторные сайты: Transformer дрозофилы

Пре-мРНК гена Transformer (Tra) D. melanogaster подвергаются альтернативному сплайсингу по модели альтернативных акцепторных сайтов. Ген Tra кодирует белок, экспрессия которого имеет место только у самок. Первичный транскрипт этого гена содержит интрон с двумя возможными акцепторными сайтами. У самцов задействован вышележащий акцепторный сайт, благодаря чему происходит включение в мРНК удлинённого варианта экзона 2, содержащего преждевременный стоп-кодон; поэтому у самцов образуется укороченный неактивный белок. У самок же образуется полноценный белок, играющий ключевую роль в определении пола и известный как Sex lethal (Sxl). Белок Sxl является репрессором сплайсинга и, связываясь с ISS в РНК-транскрипте Tra рядом с вышележащим акцепторным сайтом, предотвращает связывание белка U2AF с полипиримидиновым трактом; в результате сплайсосома связывается с нижележащим акцепторным сайтом, что приводит к удалению преждевременного стоп-кодона. Полученная мРНК кодирует белок Tra, который сам выступает регулятором альтернативного сплайсинга других связанных с полом генов (см. выше пример гена dsx)[3].
Альтернативный сплайсинг рецептора Fas

В результате альтернативного сплайсинга происходит синтез множества изоформ рецептора Fas[англ.]. У человека две нормальные изоформы данного рецептора образуются по механизму пропуска экзона. мРНК, содержащая 6 экзонов, кодирует мембраносвязанную форму рецептора Fas, которая стимулирует апоптоз. Повышенное образование рецептора Fas в клетках, постоянно подвергающихся воздействию солнечного света, и отсутствие этого рецептора в клетках рака кожи свидетельствуют о том, что рассматриваемый механизм играет важную роль в элиминации клеток, вставших на путь превращения в раковые[38]. При пропуске экзона 6 образуется водорастворимая изоформа белка Fas, которая стимулировать апоптоз неспособна. Выбор между вставкой или пропуском экзона зависит от действия двух белков-антагонистов: TIA-1[англ.] и PTB.
Донорный сайт, расположенный на 5'-конце интрона, следующим после экзона 6 в пре-мРНК, плохо согласуется с консенсусной последовательностью сплайсинга, и не всегда связывается с snRNP U1[5]. Если связывания U1 не происходит, экзон 6 пропускается (картинка а на рисунке справа). Связывание белка TIA-1 с интронным энхансером сплайсинга стабилизирует связывание U1. Образующийся на 5'-конце интрона донорный сайт помогает связываться фактору сплайсинга U2AF с 3'-сайтом сплайсинга, расположенным выше экзона, хотя механизм этого ещё не понятен (картинка b на рисунке справа)[39]. Экзон 6 содержит обогащённый пиримидинами сайленсер сплайсинга (ure6), с которым может связываться PTB. Если связывание PTB имеет место, то донорный сайт на 5'-конце интрона не способствует связыванию фактора U2AF, и экзон пропускается (картинка с на рисунке справа).
Описанный выше механизм является примером определения экзона при сплайсинге. Сплайсосома собирается в области интрона, и snRNP укладывают РНК так, что 5'- и 3'-концы интрона соединяются. Однако в описанном выше случае происходит также взаимодействие концов экзона. В этом случае взаимодействия, определяющие границы экзона, необходимы для связывания коровых факторов сплайсинга до сборки сплайсосомы на границах фланкирующих интронов[39].
Конкуренция репрессора и активатора: экзон 2 гена tat ВИЧ-1

ВИЧ — ретровирус, являющийся причиной развития СПИДа — образует единственную пре-мРНК, из которой далее посредством альтернативного сплайсинга образуется более 40 различных мРНК[40]. Равновесие между сплайсированными по-разному транскриптами обеспечивает образование мРНК, кодирующих все белки, необходимые для репликации вируса[41]. Один из по-разному сплайсированных транскриптов содержит транскрипт гена tat[англ.], у которого экзон 2 является кассетным, то есть может быть либо включён в итоговый транскрипт, либо не включён. Включение этого экзона регулируют репрессор сплайсинга hnRNP A1 и SR-белок SC35. В экзоне 2 имеет место перекрывание сайленсерной последовательности (ESS) и энхансерной последовательности (ESE) перекрываются. Если с ESS связывается репрессор А1, то он запускает кооперативное связывание молекул А1, закрывая 5'-концевой донорный сайт выше экзона 2 и препятствуя связыванию U2AF35 с полипиримидиновым трактом. Если SC35 связывается с ESE, то он препятствует связыванию А1, и 5'-донорный сайт остаётся доступным для сплайсосомы. Конкуренция между репрессором и активатором приводит к образованию РНК, соответственно содержащей или не содержащей экзон 2[40].
Адаптивное значение
Альтернативный сплайсинг — это одно из исключений из правила, по которому одному гену соответствует один белок (гипотеза «один ген — один фермент»)[42]. Корректнее было бы сказать: «один ген — много полипептидов». Внешняя информация нужна для того, чтобы решить, какой именно полипептид образовать с данной мРНК. Поскольку способы регуляции наследуются, то это открывает мутациям новый путь к изменению экспрессии генов[9].
Предполагается, что для эукариот альтернативный сплайсинг — очень важный шаг на пути к повышению эффективности экспрессии генов, поскольку он даёт возможность хранить информацию более экономно. Один ген может давать начало нескольким белкам, а не одному, поэтому одно и то же разнообразие протеома можно получить с генома существенно меньшего размера[3]. Это также обеспечивает эволюционную гибкость. Единственная точечная мутация может привести к включению или исключению экзона из транскрипта, благодаря чему может быть получена новая изоформа белка без потери его основной формы[3]. Обнаружены действительно неупорядоченные регионы, которые содержат много неконститутивных экзонов, поэтому изоформы белка могут выполнять новые функции, изменяя функциональные модули в этих местах[43][44][45]. Сравнительные оценки показывают, что возникновение альтернативного сплайсинга в ходе эволюции предшествовало появлению многоклеточности; предполагают, что альтернативный сплайсинг был одним из средств, обеспечивающих возникновение многоклеточных организмов[46].
Исследования в рамках проекта «Геном человека», а также других проектов по секвенированию геномов показали, что геном человека всего лишь на 30 % больше генома нематоды Caenorhabditis elegans и всего лишь в два раза больше, чем у плодовой мушки Drosophila melanogaster. Эти данные наводят на мысль, что сложность человека и позвоночных животных вообще может быть связана с более активным, по сравнению с беспозвоночными, использованию альтернативного сплайсинга[47][48]. Однако дальнейшее изучение геномных последовательностей человека, мыши, крысы, коровы, D. melanogaster, C. elegans и растения Arabidopsis thaliana показало, что между человеком и другими эукариотами не наблюдается значительной разницы в использовании альтернативного сплайсинга[49]. Имеются, впрочем, сведения, что полученные данные представляют собой артефакт, связанный с неравномерным включением в сравнительный анализ последовательностей комплементарной ДНК, взятых у различных организмов. При сравнении частот использования альтернативного сплайсинга для случайных выборок генов, полученных от сравниваемых организмов, оказалось, что у позвоночных альтернативный сплайсинг всё же встречается чаще, чем у беспозвоночных[50].
Клиническое значение
Изменения в аппарате процессинга РНК могут приводить к нарушениям сплайсинга многих транскриптов, а однонуклеотидные замены в сайтах сплайсинга или цис-регуляторных сайтах сплайсинга приводят к различиям в сплайсинге одного и того же гена, как и при сплайсинге транскрипта мутировавшего гена. В работе 2005 года было показано, что свыше 60 % мутаций, приводящих к развитию болезней, влияют не на саму кодирующую последовательность, а на сплайсинг[51]. Показано также, что примерно треть наследственных заболеваний связана с нарушениями сплайсинга[25].
Аномально сплайсированные мРНК встречаются в заметной доле раковых клеток[7][8][10]. Анализ RNA-Seq и протеомов показал выраженные различия в экспрессии сплайсинговых изоформ тех белков, которые участвуют в сигнальных путях, связанных с развитием рака[52]. Неизвестно, влияют ли нарушения сплайсинга на развития рака напрямую, или же они являются следствием поломки клеточных процессов в связи с переходом к раковому росту. Отмечено, что при некоторых видах рака — таких, как рак толстой кишки или рак простаты, количество ошибок в сплайсинге у разных пациентов значительно варьировало; данный феномен назвали транскриптомной нестабильностью[53][54].
Кроме этого, было показано, что транскриптомная нестабильность связана с пониженной экспрессией генов факторов сплайсинга. Действительно, в общем случае в раковых клетках альтернативный сплайсинг используется меньше, чем у нормальных клеток, причём модели сплайсинга тоже различаются. Так, в раковых клетках сохранение интрона происходит чаще, чем в нормальных клетках, а пропуск экзона — реже. Особенности сплайсинга в раковых клетках могут быть связаны с высокой частотой соматических мутаций в генах факторов сплайсинга, а некоторые особенности могут быть обусловлены изменениями в фосфорилировании транс-регуляторных факторов сплайсинга[55][9]. Некоторые особенности сплайсинга могут быть связаны с изменением относительного количества его факторов; например, в клетках рака груди наблюдаются повышенные уровни фактора сплайсинга SF2/ASF[англ.][56]. В одном исследовании было показано, что относительно небольшая доля (383 из 26000) вариантов альтернативного сплайсинга в раковых клетках встречалась значительно чаще, чем в нормальных; отсюда следует, что существует ограниченное количество генов, аберрантный сплайсинг которых ведёт к развитию опухоли[57]. Считается, однако, что губительное действие нарушенного сплайсинга сдерживается особым клеточным посттранскрипционным механизмом контроля — нонсенс-опосредованным распадом[58].
Примером гена, специфический вариант сплайсинга которого связан у человека с развитием рака, служит один из генов DNMT. Три гена DNMT кодируют ферменты, которые добавляют метильные группы к ДНК, и модификация данных генов часто имеет регуляторные эффекты. Несколько аномально сплайсированных мРНК гена DNMT3B[англ.] было найдено в опухолях и клетках раковых линий[англ.]. Экспрессия двух из этих мРНК вызывала изменения в метилировании ДНК в данных клетках. Клетки с одной ненормальной мРНК росли вдвое быстрее, чем контрольные клетки, поэтому обнаруженные мРНК связывают с развитием рака[9].
Другим примером может служить протоонкоген Ron (MST1R). Важным свойством раковых клеток является их способность мигрировать (метастазировать) в нормальные ткани и нарушать их работу. Образование аномально сплайсированной мРНК Ron было связано с повышенными уровнями SF2/ASF в клетках рака груди. Ненормальная изоформа Ron, транслированная с этой мРНК, увеличивала подвижность клеток[56].
Сверхэкспрессия укороченного варианта белка FOSB[англ.] — ΔFosB — в специфической популяции нейронов прилежащего ядра лежит в основе возникновения и поддержания привыкания к наркотикам и естественному вознаграждению (англ. natural reward)[59][60][61][62].
Недавние исследования показывают на роль структуры хроматина и модификаций гистонов в регуляции альтернативного сплайсинга. Поэтому эпигенетические факторы могут влиять не только на экспрессию генов, но и на их сплайсинг[63].
Полногеномный анализ
Полногеномный анализ альтернативного сплайсинга — сложная задача. Обычно альтернативно сплайсированные транскрипты обнаруживают при сравнении экспрессируемых последовательностей-меток[англ.] (англ. Expressed sequence tag, EST). Большинство библиотек EST[англ.] собраны из очень ограниченного числа тканей, поэтому тканеспецифичные транскрипты ранее не были учтены. Однако появились высокопроизводительные методы для изучения сплайсинга — такие, как ДНК-микрочипы и глубокое секвенирование[англ.] (англ. deep sequencing). Эти методы могут быть использованы для поиска полиморфизмов и мутаций, расположенных в тех элементов сплайсинга, которые влияют на связывание белков, или в их ближайшей окрестности. Сочетая данные методы с такими приёмами исследования сплайсинга, как in vitro анализ репортерных генов, можно изучать влияние полиморфизмов и мутаций на сплайсинг пре-мРНК[25][30][64].
При анализе с помощью микрочипов используют фрагменты ДНК, являющиеся отдельными экзонами (такие, как микрочип Affymetrix[англ.]) или границами между экзонами. Затем в микрочип добавляют меченую кДНК из интересующей ткани. Эта пробная кДНК комплементарно связывается с фрагментами ДНК, уже находящимися в микрочипе. Благодаря данному методу можно выявить присутствие определённых альтернативно сплайсированных мРНК[65].
Метод CLIP (англ. Cross-linking and immunoprecipitation — образование поперечных сшивок и иммунопреципитация) использует УФ-излучение для образования сшивок между белками и РНК, подвергающихся сплайсингу. Затем транс-действующие регуляторные белки сплайсинга осаждаются при помощи специальных антител. Когда РНК, связанную с белком, изолируют и клонируют, то определяется последовательность РНК, связанная с регуляторным белком[6]. Использование репортерных генов позволяет выявить белки сплайсинга, участвующие в специфичных случаях альтернативного сплайсинга: в зависимости от того, каким образом прошёл сплайсинг, репортёрный ген будет давать начало двум разным флуоресцентным белкам. Данный метод был использован для выделения мутантов с нарушенным сплайсингом и выявления регуляторных белков сплайсинга, инактивированных у этих мутантов[6].
См. также
Примечания
- ↑ 1,0 1,1 Blencowe B. J. Alternative Splicing: New Insights from Global Analyses // Cell. — 2006. — Vol. 126, no. 1. — P. 37—47. — doi:10.1016/j.cell.2006.06.023.
- ↑ 2,0 2,1 Дымшиц Г. М., Саблина О. В. «Разорванные» гены и сплайсинг // Вавиловский журнал генетики и селекции. — 2014. — Т. 18, № 1. — С. 71—80.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 Black D. L. Mechanisms of Alternative Pre-Messenger RNA Splicing // Annual Review of Biochemistry. — 2003. — Vol. 72. — P. 291—336. — doi:10.1146/annurev.biochem.72.121801.161720. — PMID 12626338.
- ↑ 4,0 4,1 Pan Qun, Shai O., Lee L. J., Frey B. J., Blencowe B. J. Deep Surveying of Alternative Splicing Complexity in the Human Transcriptome by High-Throughput Sequencing // Nature Genetics. — 2008. — Vol. 40, no. 12. — P. 1413—1415. — doi:10.1038/ng.259. — PMID 18978789.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 5,6 5,7 5,8 5,9 Matlin A. J., Clark F., Smith C. W. Understanding Alternative Splicing: Towards a Cellular Code // Nature Reviews. Molecular Cell Biology. — 2005. — Vol. 6, no. . — P. 386—398. — doi:10.1038/nrm1645. — PMID 15956978.
- ↑ 6,0 6,1 6,2 David C. J., Manley J. L. The Search for Alternative Splicing Regulators: New Approaches Offer a Path to a Splicing Code // Genes & Development. — 2008. — Vol. 22, no. 3. — P. 279—285. — doi:10.1101/gad.1643108. — PMID 18245441.
- ↑ 7,0 7,1 Skotheim R. I., Nees M. Alternative Splicing in Cancer: Noise, Functional, or Systematic? // The International Journal of Biochemistry & Cell Biology. — 2007. — Vol. 39, no. 7-8. — P. 1432—1449. — doi:10.1016/j.biocel.2007.02.016. — PMID 17416541.
- ↑ 8,0 8,1 He Chunjiang, Zhou Fang, Zuo Zhixiang, Cheng Hanhua, Zhou Rongjia. A Global View of Cancer-Specific Transcript Variants by Subtractive Transcriptome-Wide Analysis // PLoS One. — 2009. — Vol. 4, no. 3. — P. e4732. — doi:10.1371/journal.pone.0004732. — PMID 19266097.
- ↑ 9,0 9,1 9,2 9,3 Fackenthal J. D., Godley L. A. Aberrant RNA Splicing and its Functional Consequences in Cancer Cells // Disease Models & Mechanisms. — 2008. — Vol. 1, no. 1. — P. 37—42. — doi:10.1242/dmm.000331. — PMID 19048051.
- ↑ 10,0 10,1 Sveen A., Kilpinen S., Ruusulehto A., Lothe R. A., Skotheim R. I. Aberrant RNA Splicing in Cancer; Expression Changes and Driver Mutations of Splicing Factor Genes // Oncogene. — 2016. — Vol. 35, no. 19. — P. 2413—2427. — doi:10.1038/onc.2015.318. — PMID 26300000.
- ↑ Zhou Jianbiao, Chng Wee-Joo. Aberrant RNA Splicing and Mutations in Spliceosome Complex in Acute Myeloid Leukemia // Stem Cell Investigation. — 2017. — Vol. 4, no. 2. — P. 6. — doi:10.21037/sci.2017.01.06. — PMID 28217708.
- ↑ Chow L. T., Gelinas R. E., Broker T. R., Roberts R. J. An Amazing Sequence Arrangement at the 5' Ends of Adenovirus 2 messenger RNA // Cell. — 1977. — Vol. 12, no. 1. — P. 1—8. — doi:10.1016/0092-8674(77)90180-5. — PMID 902310.
- ↑ Berget S. M., Moore C., Sharp P. A. Spliced Segments at the 5' Terminus of Adenovirus 2 Late mRNA // Proc. Nat. Acad. Sci. USA. — 1977. — Vol. 74, no. 8. — P. 3171—3175. — PMID 269380.
- ↑ 14,0 14,1 Leff S. E., Rosenfeld M. G., Evans R. M. Complex Transcriptional Units: Diversity in Gene Expression by Alternative RNA Processing // Annual Review of Biochemistry. — 1986. — Vol. 55. — P. 1091—1117. — doi:10.1146/annurev.bi.55.070186.005303. — PMID 3017190.
- ↑ Chow L. T., Broker T. R. The Spliced Structures of Adenovirus 2 Fiber Message and the Other Late mRNAs // Cell. — 1978. — Vol. 15, no. 2. — P. 497—510. — doi:10.1016/0092-8674(78)90019-3. — PMID 719751.
- ↑ Nevins J. R., Darnell J. E. Steps in the Processing of Ad2 mRNA: Poly(A)+ Nuclear Sequences Are Conserved and Poly(A) Addition Precedes Splicing // Cell. — 1978. — Vol. 15, no. 4. — P. 1477—1493. — doi:10.1016/0092-8674(78)90071-5. — PMID 729004.
- ↑ Rosenfeld M. G., Amara S. G., Roos B. A., Ong E. S., Evans R. M. Altered Expression of the Calcitonin Gene Associated with RNA Polymorphism // Nature. — 1981. — Vol. 290, no. 5801. — P. 63—65. — PMID 7207587.
- ↑ Rosenfeld M. G., Lin C. R., Amara S. G., Stolarsky L., Roos B. A., Ong E. S., Evans R. M. Calcitonin mRNA Polymorphism: Peptide Switching Associated with Alternative RNA Splicing Events // Proc. Nat. Acad. Sci. USA. — 1982. — Vol. 79, no. 6. — P. 1717—1721. — PMID 6952224.
- ↑ Maki R., Roeder W., Traunecker A., Sidman C., Wabl M., Raschke W., Tonegawa S. The Role of DNA Rearrangement and Alternative RNA Processing in the Expression of Immunoglobulin Delta Genes // Cell. — 1981. — Vol. 24, no. 2. — P. 353—365. — doi:10.1016/0092-8674(81)90325-1. — PMID 6786756.
- ↑ Schmucker D., Clemens J. C., Shu Huidy, Worby C. A., Xiao Jian, Muda M., Dixon J. E., Zipursky S. L. Drosophila Dscam Is an Axon Guidance Receptor Exhibiting Extraordinary Molecular Diversity // Cell. — 2000. — Vol. 101, no. 6. — P. 671—684. — doi:10.1016/S0092-8674(00)80878-8. — PMID 10892653.
- ↑ 21,0 21,1 21,2 21,3 Sammeth M., Foissac S., Guigó R. A General Definition and Nomenclature for Alternative Splicing Events // PLOS Computational Biology. — 2008. — Vol. 4, no. 8. — P. e1000147. — doi:10.1371/journal.pcbi.1000147. — PMID 18688268.
- ↑ 22,0 22,1 Гены по Льюину, 2017, с. 579.
- ↑ 23,0 23,1 23,2 23,3 23,4 23,5 23,6 Tian Na, Li Jialiang, Shi Jinming, Sui Guangchao. From General Aberrant Alternative Splicing in Cancers and Its Therapeutic Application to the Discovery of an Oncogenic DMTF1 Isoform // International Journal of Molecular Sciences. — 2017. — Vol. 18, no. 3. — P. e191. — doi:10.3390/ijms18030191. — PMID 28257090.
- ↑ Atambayeva Sh. A., Khailenko V. A., Ivashchenko A. T. Intron and Exon Length Variation in Arabidopsis, Rice, Nematode, and Human // Molecular Biology. — 2008. — Vol. 42, no. 2. — P. 312—320. — doi:10.1134/S0026893308020180.
- ↑ 25,0 25,1 25,2 25,3 Lim Kian Huat, Ferraris L., Filloux M. E., Raphael B. J., Fairbrother W. G. Using Positional Distribution to Identify Splicing Elements and Predict pre-mRNA Processing Defects in Human Genes // Proc. Nat. Acad. Sci. USA. — 2011. — Vol. 108, no. 27. — P. 11093—11098. — doi:10.1073/pnas.1101135108. — PMID 21685335.
- ↑ Gao Kaiping, Masuda A., Matsuura T,, Ohno K. Human Branch Point Consensus Sequence is yUnAy // Nucleic Acids Research. — 2008. — Vol. 36, no. 7. — P. 2257—2267. — doi:10.1093/nar/gkn073. — PMID 18285363.
- ↑ Clark D. . Molecular biology. — Amsterdam: Elsevier Academic Press, 2005. — 784 p. — ISBN 0-12-175551-7.
- ↑ Warf M. B., Berglund J. A. Role of RNA Structure in Regulating pre-mRNA Splicing // Trends in Biochemical Sciences. — 2010. — Vol. 35, no. 3. — P. 169—178. — doi:10.1016/j.tibs.2009.10.004. — PMID 19959365.
- ↑ Reid D. C., Chang B. L., Gunderson S. I., Alpert L., Thompson W. A., Fairbrother W. G. Next-Generation SELEX Identifies Sequence and Structural Determinants of Splicing Factor Binding in Human pre-mRNA Sequence // RNA. — 2009. — Vol. 15, no. 12. — P. 2385—2397. — doi:10.1261/rna.1821809. — PMID 19861426.
- ↑ 30,0 30,1 30,2 30,3 Wang Zefeng, Burge C. B. Splicing Regulation: from a Parts List of Regulatory Elements to an Integrated Splicing Code // RNA. — 2008. — Vol. 14, no. 5. — P. 802—813. — doi:10.1261/rna.876308. — PMID 18369186.
- ↑ 31,0 31,1 Barash Y., Calarco J. A., Gao Weijun, Pan Qun, Wang Xinchen, Shai O., Blencowe B. J., Frey B. J. Deciphering the Splicing Code // Nature. — 2010. — Vol. 465, no. 7294. — P. 53—59. — doi:10.1038/nature09000. — PMID 20445623.
- ↑ Das S., Krainer A. R. Emerging Functions of SRSF1, Splicing Factor and Oncoprotein, in RNA Metabolism and Cancer // Molecular Cancer Research. — 2014. — Vol. 12, no. 9. — P. 1195—1204. — doi:10.1158/1541-7786.MCR-14-0131. — PMID 24807918.
- ↑ Manley J. L., Krainer A. R. A Rational Nomenclature for Serine/Arginine-Rich Protein Splicing Factors (SR Proteins) // Genes & Development. — 2010. — Vol. 24, no. 11. — P. 1073—1074. — doi:10.1101/gad.1934910. — PMID 20516191.
- ↑ Ke Shengdong, Zhang Xiang H.-F., Chasin L. A. Positive Selection Acting on Splicing Motifs Reflects Compensatory Evolution // Genome Research. — 2008. — Vol. 18, no. 4. — P. 533—543. — doi:10.1101/gr.070268.107. — PMID 18204002.
- ↑ Fairbrother W. G., Holste D., Burge C. B., Sharp P. A. Single Nucleotide Polymorphism-Based Validation of Exonic Splicing Enhancers // PLOS Biology. — 2004. — Vol. 2, no. 9. — P. e268. — doi:10.1371/journal.pbio.0020268. — PMID 15340491.
- ↑ 36,0 36,1 Lynch K. W., Maniatis T. Assembly of Specific SR Protein Complexes on Distinct Regulatory Elements of the Drosophila Doublesex Splicing Enhancer // Genes & Development. — 1996. — Vol. 10, no. 16. — P. 2089—2101. — doi:10.1101/gad.10.16.2089. — PMID 8769651.
- ↑ Graveley B. R., Hertel K. J., Maniatis T. The Role of U2AF35 and U2AF65 in Enhancer-Dependent Splicing // RNA. — 2001. — Vol. 7, no. 6. — P. 806—818. — PMID 11421359.
- ↑ Filipowicz E., Adegboyega P., Sanchez R. L., Gatalica Z. Expression of CD95 (Fas) in Sun-Exposed Human Skin and Cutaneous Carcinomas // Cancer. — 2002. — Vol. 94, no. 3. — P. 814—819. — doi:10.1002/cncr.10277. — PMID 11857317.
- ↑ 39,0 39,1 Izquierdo J. M., Majós N., Bonnal S., Martínez C., Castelo R., Guigó R., Bilbao D., Valcárcel J. Regulation of Fas Alternative Splicing by Antagonistic Effects of TIA-1 and PTB on Exon Definition // Molecular Cell. — 2005. — Vol. 19, no. 4. — P. 475—484. — doi:10.1016/j.molcel.2005.06.015. — PMID 16109372.
- ↑ 40,0 40,1 Zahler A. M., Damgaard C. K., Kjems J., Caputi M. SC35 and Heterogeneous Nuclear Ribonucleoprotein A/B Proteins Bind to a Juxtaposed Exonic Splicing Enhancer/Exonic Splicing Silencer Element to Regulate HIV-1 tat Exon 2 Splicing // The Journal of Biological chemistry. — 2004. — Vol. 279, no. 11. — P. 10077—10084. — doi:10.1074/jbc.M312743200. — PMID 14703516.
- ↑ Jacquenet S., Méreau A., Bilodeau P. S., Damier L., Stoltzfus C. M., Branlant C. A Second Exon Splicing Silencer within Human Immunodeficiency Virus Type 1 tat Exon 2 Represses Splicing of Tat mRNA and Binds Protein hnRNP H // The Journal of Biological Chemistry. — 2001. — Vol. 276, no. 44. — P. 40464—40475. — doi:10.1074/jbc.M104070200. — PMID 11526107.
- ↑ HHMI Bulletin September 2005: Alternative Splicing. // Website www.hhmi.org. Дата обращения: 26 мая 2009. Архивировано 22 июня 2009 года.
- ↑ Romero P. R., Zaidi S., Fang Ya Yin, Uversky V. N., Radivojac P., Oldfield C. J., Cortese M. S., Sickmeier M., LeGall T., Obradovic Z., Dunker A. K. Alternative Splicing in Concert with Protein Intrinsic Disorder Enables Increased Functional Diversity in Multicellular Organisms // Proc. Nat. Acad. Sci. USA. — 2006. — Vol. 103, no. 22. — P. 8390—8395. — doi:10.1073/pnas.0507916103. — PMID 16717195.
- ↑ Li Hong-Dong, Menon R., Omenn G. S., Guan Yuanfang. The Emerging Era of Genomic Data Integration for Analyzing Splice Isoform Function // Trends in Genetics. — 2014. — Vol. 30, no. 8. — P. 340—347. — doi:10.1016/j.tig.2014.05.005. — PMID 24951248.
- ↑ Eksi R., Li Hong-Dong, Menon R., Wen Yuchen, Omenn G. S., Kretzler M., Guan Yuanfang. Systematically Differentiating Functions for Alternatively Spliced Isoforms through Integrating RNA-seq Data // PLOS Computational Biology. — 2013. — Vol. 9, no. 11. — P. e1003314. — doi:10.1371/journal.pcbi.1003314. — PMID 24244129.
- ↑ Irimia M., Rukov J. L., Penny D., Roy S. W. Functional and Evolutionary Analysis of Alternatively Spliced Genes Is Consistent with an Early Eukaryotic Origin of Alternative Splicing // BMC Evolutionary Biology. — 2007. — Vol. 7. — P. 188. — doi:10.1186/1471-2148-7-188. — PMID 17916237.
- ↑ Ewing B., Green P. Analysis of Expressed Sequence Tags Indicates 35,000 Human Genes // Nature Genetics. — 2000. — Vol. 25, no. 2. — P. 232—234. — doi:10.1038/76115. — PMID 10835644.
- ↑ Roest Crollius H., Jaillon O., Bernot A., Dasilva C., Bouneau L., Fischer C., Fizames C., Wincker P., Brottier P., Quétier F., Saurin W., Weissenbach J. Estimate of Human Gene Number Provided by Genome-Wide Analysis using Tetraodon nigroviridis DNA Sequence // Nature Genetics. — 2000. — Vol. 25, no. 2. — P. 235—238. — doi:10.1038/76118. — PMID 10835645.
- ↑ Brett D., Pospisil H., Valcárcel J., Reich J., Bork P. Alternative Splicing and Genome Complexity // Nature Genetics. — 2002. — Vol. 30, no. 1. — P. 29—30. — doi:10.1038/ng803. — PMID 11743582.
- ↑ Kim E., Magen A., Ast G. Different Levels of Alternative Splicing among Eukaryotes // Nucleic Acids Research. — 2007. — Vol. 35, no. 1. — P. 125—131. — doi:10.1093/nar/gkl924. — PMID 17158149.
- ↑ López-Bigas N., Audit B., Ouzounis C., Parra G., Guigó R. Are Splicing Mutations the Most Frequent Cause of Hereditary Disease? // FEBS Letters. — 2005. — Vol. 579, no. 9. — P. 1900—1903. — doi:10.1016/j.febslet.2005.02.047. — PMID 15792793.
- ↑ Omenn G. S., Guan Yuanfang, Menon R. A New Class of Protein Cancer Biomarker Candidates: Differentially Expressed Splice Variants of ERBB2 (HER2/neu) and ERBB1 (EGFR) in Breast Cancer Cell Lines // Journal of Proteomics. — 2014. — Vol. 107. — P. 103—112. — doi:10.1016/j.jprot.2014.04.012. — PMID 24802673.
- ↑ Sveen A., Johannessen B., Teixeira M. R., Lothe R. A., Skotheim R. I. Transcriptome Instability as a Molecular Pan-Cancer Characteristic of Carcinomas // BMC Genomics. — 2014. — Vol. 15. — P. 672. — doi:10.1186/1471-2164-15-672. — PMID 25109687.
- ↑ Sveen A., Agesen T. H., Nesbakken A., Rognum T. O., Lothe R. A., Skotheim R. I. Transcriptome Instability in Colorectal Cancer Identified by Exon Microarray Analyses: Associations with Splicing Factor Expression Levels and Patient Survival // Genome Medicine. — 2011. — Vol. 3, no. 5. — P. 32. — doi:10.1186/gm248. — PMID 21619627.
- ↑ Kim E., Goren A., Ast G. Insights into the Connection between Cancer and Alternative Splicing // Trends in Genetics. — 2008. — Vol. 24, no. 1. — P. 7—10. — doi:10.1016/j.tig.2007.10.001. — PMID 18054115.
- ↑ 56,0 56,1 Ghigna C., Giordano S., Shen Haihong, Benvenuto F., Castiglioni F., Comoglio P. M., Green M. R., Riva S., Biamonti G. Cell Motility is Controlled by SF2/ASF through Alternative Splicing of the Ron Protooncogene // Molecular Cell. — 2005. — Vol. 20, no. 6. — P. 881—890. — doi:10.1016/j.molcel.2005.10.026. — PMID 16364913.
- ↑ Hui Lijian, Zhang Xin, Wu Xin, Lin Zhixin, Wang Qingkang, Li Yixue, Hu Gengxi. Identification of Alternatively Spliced mRNA Variants Related to Cancers by Genome-Wide ESTs Alignment // Oncogene. — 2004. — Vol. 23, no. 17. — P. 3013—3023. — doi:10.1038/sj.onc.1207362. — PMID 15048092.
- ↑ Danckwardt S., Neu-Yilik G., Thermann R., Frede U., Hentze M. W., Kulozik A. E. Abnormally Spliced β-Globin mRNAs: a Single Point Mutation Generates Transcripts Sensitive and Insensitive to Nonsense-Mediated mRNA Decay // Blood. — 2002. — Vol. 99, no. 5. — P. 1811—1816. — PMID 11861299.
- ↑ Nestler E. J. Cellular Basis of Memory for Addiction // Dialogues in Clinical Neuroscience. — 2013. — Vol. 15, no. 4. — P. 431—443. — PMID 24459410.
- ↑ Ruffle J. K. Molecular Neurobiology of Addiction: What’s All the (Δ)FosB about? // The American Journal of Drug and Alcohol Abuse. — 2014. — Vol. 40, no. 6. — P. 428—437. — doi:10.3109/00952990.2014.933840. — PMID 25083822.
- ↑ Biliński P., Wojtyła A., Kapka-Skrzypczak L., Chwedorowicz R., Cyranka M., Studziński T. Epigenetic Regulation in Drug Addiction // Annals of Agricultural and Environmental Medicine. — 2012. — Vol. 19, no. 3. — P. 491—496. — PMID 23020045.
- ↑ Olsen C. M. Natural Rewards, Neuroplasticity, and Non-Drug Addictions // Neuropharmacology. — 2011. — Vol. 61, no. 7. — P. 1109—1122. — doi:10.1016/j.neuropharm.2011.03.010. — PMID 21459101.
- ↑ Luco R. F., Allo M., Schor I. E., Kornblihtt A. R., Misteli T. Epigenetics in Alternative pre-mRNA Splicing // Cell. — 2011. — Vol. 144, no. 1. — P. 16—26. — doi:10.1016/j.cell.2010.11.056. — PMID 21215366.
- ↑ Fairbrother W. G., Yeh R. F., Sharp P. A., Burge C. B. Predictive Identification of Exonic Splicing Enhancers in Human Genes // Science. — 2002. — Vol. 297, no. 5583. — P. 1007—1013. — doi:10.1126/science.1073774. — PMID 12114529.
- ↑ Pan Qun, Shai O., Misquitta C., Zhang Wen, Saltzman A. L., Mohammad N., Babak T., Siu H., Hughes T. R., Morris Q. D., Frey B. J., Blencowe B. J. Revealing Global Regulatory Features of Mammalian Alternative Splicing Using a Quantitative Microarray Platform // Molecular Cell. — 2004. — Vol. 16, no. 6. — P. 929—941. — doi:10.1016/j.molcel.2004.12.004. — PMID 15610736.
Литература
- Кребс Дж., Голдштейн Э., Килпатрик С. . Гены по Льюину. — М.: Лаборатория знаний, 2017. — 919 с. — ISBN 978-5-906828-24-8.
Ссылки
- Коллекция баз данных альтернативного сплайсинга.
- Старокадомский, Пётр. Белки против РНК — кто первым придумал сплайсинг?. // Сайт Biomolecula.ru (30 ноября 2007). Дата обращения: 20 марта 2018.