Адалимумаб
| Адалимумаб | |
|---|---|
 | |
| Химическое соединение | |
| CAS | 331731-18-1 |
| DrugBank | DB00051 |
| Состав | |
| Другие названия | |
| Humira, Mabura, Exemptia | |
Адалимума́б — медицинский препарат[1], продаваемый под торговой маркой Humira. Препарат используется для лечения ревматоидного артрита, псориатического артрита, анкилозирующего спондилита, болезни Крона, язвенного колита, псориаза, гнойного аденита, увеита и ювенильного идиопатического артрита[2][3][4][5]. Обычно использование препарата рекомендуется только людям, которые отказались от других методов лечения[4]. Его вводят путем инъекции под кожу[3].
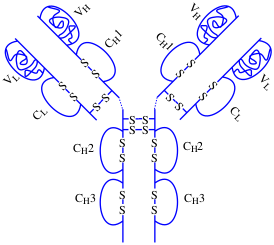
Адалимумаб является селективным иммунодепрессантом. Представляет собой рекомбинантное моноклональное антитело, пептидная последовательность которого идентична lgG1 человека.
Включён в WHO Model List of Essential Medicines — список важнейших лекарственных средств, составляемый Всемирной организацией здравоохранения[6].
Он доступен как биоподобный препарат[7].
Биоаналоги: 2016 г. – adalimumab-atto (Amjevita), 2017 – adalimumab-adbm (Cyltezo)[8], 2018 – adalimumab-adaz (Hyrimoz), 2019 – adalimumab-afzb (Abrilada) и adalimumab-bwwd (Hadlima), 2020 – adalimumab-fkjp (Hulio).
Общие побочные эффекты включают: инфекции верхних дыхательных путей, боль в месте инъекции, сыпь и головную боль[3]. Другие побочные эффекты могут включать серьезные инфекции, рак, анафилактический шок, реактивацию гепатита B, рассеянный склероз, сердечную недостаточность, печеночную недостаточность и апластическую анемию[3]. Использование препарата во время беременности не рекомендуется, но некоторые источники показывают, что использование во время грудного вскармливания может быть безопасным[9][4].
В 2018 году Адалимумаб занимал 178-е место среди наиболее часто назначаемых лекарств в Соединенных Штатах. За год было выписано более 3 миллионов рецептов[10][11].
Фармакологическое действие
Адалимумаб селективно связывается с фактором некроза опухоли (ФНО) и нейтрализует его биологические функции за счет блокады цитокина, который принимает участие в регуляции нормального воспалительного и иммунного ответа. Повышенные уровни ФНО обнаруживают в синовиальной жидкости у больных ревматоидным артритом, псориатическим артритом и анкилозирующим спондилитом. ФНО играет важную роль в развитии патологического воспаления и разрушения суставной ткани, характерных для этих заболеваний.
Адалимумаб также вызывает ответные биологические реакции, которые индуцируются или регулируются ФНО, включая изменения количества молекул адгезии, вызывающих миграцию лейкоцитов.
У больных ревматоидным артритом адалимумаб вызывает быстрое снижение уровней острофазных показателей воспаления (С-реактивного белка и СОЭ) и сывороточных уровней цитокинов (ИЛ6). Кроме того, отмечается снижение сывороточной активности матриксных металлопротеиназ (ММР-1 и ММР-3), вызывающих ремоделирование тканей, которое лежит в основе разрушения хряща.
Медицинское использование
Как и другие TNF-ингибиторы, это иммунодепрессивный препарат, используемый для лечения аутоиммунных заболеваний, таких как ревматоидный артрит[2][12].
Адалимумаб вводится подкожно[2][3]. По большинству показаний поддерживающая терапия – это инъекции каждые две недели[2][3][13].
В ЕС он показан для лечения:
- бляшечный псориаз (заболевание, вызывающее появление красных чешуйчатых пятен на коже)[13];
- псориатический артрит (заболевание, вызывающее появление красных чешуйчатых пятен на коже с воспалением суставов)[13];
- ревматоидный артрит (заболевание, вызывающее воспаление суставов)[13];
- осевой спондилоартрит (воспаление позвоночника, вызывающее боль в спине), включая анкилозирующий спондилит, и когда рентген не показывает заболевания, но есть явные признаки воспаления[13];
- полиартикулярный ювенильный идиопатический артрит и активный артрит, связанный с энтезитом (оба редких заболевания, вызывающие воспаление в суставах)[13];
- Болезнь Крона (заболевание, вызывающее воспаление кишечника)[13];
- язвенный колит (заболевание, вызывающее воспаление и язвы на слизистой оболочке кишечника)[13];
- гнойный гидраденит (инверсные угри), хроническое кожное заболевание, вызывающее уплотнения, абсцессы (скопления гноя) и рубцы на коже[13];
- неинфекционный увеит (воспаление слоя под белком глазного яблока)[13];
- хронические случаи агрессивного прогрессирующего легочного и костного саркоидоза[13].
Ревматоидный артрит
Было показано, что адалимумаб уменьшает признаки и симптомы умеренного и тяжелого ревматоидного артрита у взрослых. Его можно использовать отдельно или в комбинации с болезнь-модифицирующими антиревматическими препаратами (БМАРП)[14]. Также было показано, что препарат эффективен при полиартикулярном ювенильном идиопатическом артрите от умеренной до тяжелой степени у детей от четырех лет и старше, и показан для лечения этого состояния. При ревматоидном артрите он показан для использования отдельно или с метотрексатом или аналогичными лекарствами в США с 2002 года[15]. Адалимумаб имеет такую же эффективность, как и метотрексат, и в сочетании почти вдвое увеличивает ответную реакцию только на метотрексат[16].
Псориатический артрит
В 2003 году адалимумаб начал проходить испытания для лечения псориаза и псориатического артрита[17].
Анкилозирующий спондилоартрит
Было показано, что адалимумаб уменьшает признаки и симптомы анкилозирующего спондилита у взрослых и одобрен для его лечения[18].
Болезнь Крона
Было показано, что адалимумаб уменьшает признаки и симптомы болезни Крона от умеренной до тяжелой[7][19][20]. Он был одобрен для такого использования в Великобритании с 2009 года[21].
Язвенный колит
Адалимумаб может быть эффективным и хорошо переносимым при язвенном колите. Он был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для лечения умеренных и тяжелых случаев у взрослых[22][23].
Бляшечный псориаз
Было показано, что адалимумаб лечит хронический бляшечный псориаз от умеренной до тяжелой степени у взрослых, страдающих этим заболеванием во многих частях тела и которым могут быть полезны инъекции или таблетки (системная терапия) или фототерапия (лечение с использованием только ультрафиолетового света или с помощью таблеток)[24]. Было показано, что адалимумаб является эффективной терапией при постоянном или периодическом применении у пациентов с умеренным и тяжелым псориазом[25].
Гнойный гидраденит
В 2015 году адалимумаб был одобрен для лечения гнойного гидраденита[5][26][27].
Ювенильный идиопатический артрит
Было показано, что адалимумаб уменьшает признаки и симптомы полиартикулярного ювенильного идиопатического артрита от умеренной до тяжелой степени у детей в возрасте от четырех лет и старше[28][29][30].
Неинфекционный увеит
Адалимумаб показан для лечения неинфекционного увеита[13].
Показания
- Среднетяжелый и тяжелый активный ревматоидный артрит (в режиме монотерапии или в комбинации с метотрексатом или другими базисными противовоспалительными препаратами);
- активный псориатический артрит (в режиме монотерапии или в комбинации с метотрексатом или другими базисными противовоспалительными препаратами);
- активный анкилозирующий спондилит.
Противопоказания
- Повышенная чувствительность к адалимумабу или любым его вспомогательным компонентам;
- Инфекционные заболевания, в том числе туберкулез;
- Беременность;
- Период лактации (во время грудного вскармливания);
- Детский и подростковый возраст до 16 лет.
С осторожностью следует назначать препарат при демиелинизирующих заболеваниях.
История
Адалимумаб был обнаружен в результате совместной работы BASF Bioresearch, Combridge Antibocation и Cambridge Antibody Technology, U.K.. Сотрудничество началось в 1993 году[31][32].
Изначально был назван как D2E7[33].
С 2008 года Адалимумаб был одобрен FDA для лечения ревматоидного артрита, псориатического артрита, анкилозирующего спондилита, болезни Крона, от умеренного до тяжелого хронического псориаза и ювенильного идиопатического артрита.
Адалимумаб, продаваемый под торговой маркой Humira, был одобрен для использования в США в 2002 году[3][34][35].
Адалимумаб, продаваемый под брендами Humira и Trudexa, был одобрен для использования в Европейском союзе в сентябре 2003 года[13][36].
Примечания
- ↑ "Drug Approval Package: Humira (adalimumab)". U.S. Food and Drug Administration (FDA) (December 31, 2002). Дата обращения: 11 декабря 2021. Архивировано 18 февраля 2020 года.
- ↑ 2,0 2,1 2,2 2,3 "Humira- adalimumab kit Humira- adalimumab injection, solution". DailyMed (2020). Дата обращения: 13 декабря 2021. Архивировано 21 июня 2020 года.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 "Adalimumab Monograph for Professionals". Drugs.com. Society of Health-System Pharmacists (2018). Дата обращения: 11 декабря 2021. Архивировано 21 ноября 2020 года.
- ↑ 4,0 4,1 4,2 British national formulary. Pharmaceutical Press (2018, BNF 76 (76 ed.)). Дата обращения: 11 декабря 2021. Архивировано 11 декабря 2021 года.
- ↑ 5,0 5,1 Megan Brooks. "FDA Clears Adalimumab (Humira) for Hidradenitis Suppurativa". Medscape (September 11, 2015). Дата обращения: 11 декабря 2021. Архивировано 21 января 2021 года.
- ↑ World Health Organization model list of essential medicines: 21st list 2019. — Geneva : World Health Organization, 2019. — ISBN WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ↑ 7,0 7,1 Laurent Peyrin-Biroulet, 2019, с. 731–738.
- ↑ FDA Approves Cyltezo, the First Interchangeable Biosimilar to Humira (англ.). FDA. Дата обращения: 21 октября 2021. Архивировано 21 октября 2021 года.
- ↑ Megan Brooks. "Adalimumab Pregnancy and Breastfeeding Warnings". Drugs.com (2019). Дата обращения: 11 декабря 2021. Архивировано 17 апреля 2021 года.
- ↑ "The Top 300 of 2021". ClinCalc (2021). Дата обращения: 11 декабря 2021. Архивировано 18 марта 2020 года.
- ↑ "Adalimumab - Drug Usage Statistics". ClinCalc (2021). Дата обращения: 11 декабря 2021. Архивировано 8 июля 2020 года.
- ↑ "Imraldi- adalimumab injection, solution". DailyMed (2020). Дата обращения: 13 декабря 2021. Архивировано 21 сентября 2020 года.
- ↑ 13,00 13,01 13,02 13,03 13,04 13,05 13,06 13,07 13,08 13,09 13,10 13,11 13,12 Humira EPAR. European Medicines Agency (EMA). Дата обращения: 18 февраля 2020. Архивировано 18 февраля 2020 года.
- ↑ Federico Navarro‐Sarabia, 2005.
- ↑ Jay P. Siegel. "Product Approval Information - Licensing Action". U.S. Food and Drug Administration (FDA) (December 31, 2002). Дата обращения: 18 декабря 2021. Архивировано 24 октября 2020 года.
- ↑ Beth Welch, 2008, с. 1406–1408.
- ↑ Scheinfeld N (2003). "Adalimumab (Humira): a review". J Drugs Dermatol. 2 (4): 375–7. PMID 12884458 Архивная копия от 18 декабря 2021 на Wayback Machine.
- ↑ Maxwell L. J., 2015.
- ↑ Daniel K. Podolsky, 2002, с. 417–29.
- ↑ Richard B. Gearry, 2019, с. 1837–1846.
- ↑ "UK – Summary of NICE Approvals in September 2009". worldpharmaoutlook.blogspot.com (September 17, 2009). Дата обращения: 18 декабря 2021. Архивировано 20 сентября 2018 года.
- ↑ "FDA approves Humira to treat ulcerative colitis" (Press release). U.S. Food and Drug Administration (FDA) (2012). Дата обращения: 21 декабря 2021.
- ↑ "Abbott's Humira (adalimumab) Receives U.S. FDA Approval for the Treatment of Adult Patients with Moderate to Severe Ulcerative Colitis". ABBOTT PARK, Ill. (2012). Дата обращения: 21 декабря 2021.
- ↑ Katherine F. Croom, 2009, с. 43–50.
- ↑ Alan Menter, 2008, с. 106–15.
- ↑ Wayne Gulliver, 2016, с. 343–351.
- ↑ Melody Maarouf, 2018, с. 441–449.
- ↑ Hermine I. Brunner, 2019, с. 1420–1430.
- ↑ Gerd Horneff, 2018, с. 166–175.
- ↑ Colleen K. Correll, 2018, с. 549–553.
- ↑ (2010) «The long and winding road to antibody therapeutics». mAbs 2 (5): 459–460. doi:10.4161/mabs.2.5.13088. ISSN 1942-0862. PMID 20978369.
- ↑ André Frenzel, 2016, с. 1177–94.
- ↑ (January 1999) «Preliminary results of early clinical trials with the fully human anti-TNFα monoclonal antibody D2E7». Ann Rheum Dis 58 (suppl 1): I70–2. doi:10.1136/ard.58.2008.i70. PMID 10577977.
- ↑ Drug Approval Package: Humira (adalimumab). U.S. Food and Drug Administration (FDA) (7 April 2017). Дата обращения: 18 февраля 2020. Архивировано 18 февраля 2020 года.
- ↑ Humira: FDA-Approved Drugs. U.S. Food and Drug Administration (FDA). Дата обращения: 18/02/2020. Архивировано 18 февраля 2020 года.
- ↑ Trudexa EPAR. European Medicines Agency (EMA). Дата обращения: 18 февраля 2020. Архивировано 18 февраля 2020 года.
Литература
- André Frenzel, Thomas Schirrmann, Michael Hust. "Phage display-derived human antibodies in clinical development and therapy" (англ.) // mAbs. — 2016. — Октябрь (т. 8, № 7). — С. 1177–94. — doi:10.1080/19420862.2016.1212149.
- Colleen K. Correll, Danielle R. Bullock, Rachel M. Cafferty, Richard K. Vehe. "Safety of weekly adalimumab in the treatment of juvenile idiopathic arthritis and pediatric chronic uveitis" (англ.) // Clin. Rheumatol. — 2018. — Февраль (т. 37, № 2). — С. 549–553. — doi:10.1007/s10067-017-3890-4.
- Gerd Horneff, Marieke M.B. Seyger, Dilek Arikan. "Safety of Adalimumab in Pediatric Patients with Polyarticular Juvenile Idiopathic Arthritis, Enthesitis-Related Arthritis, Psoriasis, and Crohn's Disease" (англ.) // J. Pediatr. — 2018. — Октябрь (т. 201). — С. 166–175. — doi:10.1016/j.jpeds.2018.05.042.
- Hermine I. Brunner, Kabita Nanda, Mary Toth, Ivan Foeldvari, John Bohnsack. "Safety and Effectiveness of Adalimumab in Patients With Polyarticular Course of Juvenile Idiopathic Arthritis: STRIVE Registry 7-Year Interim Results" (англ.) // Arthritis Care & Research. — 2019. — Август (т. 72, № 10). — С. 1420–1430. — doi:10.1002/acr.24044.
- Melody Maarouf, Ashley K. Clark, Dylan E. Lee, Vivian Y. Shi. "Targeted treatments for hidradenitis suppurativa: a review of the current literature and ongoing clinical trials" (англ.) // Journal of Dermatological Treatment. — 2018. — Август (т. 29, № 4). — С. 441–449. — doi:10.1080/09546634.2017.1395806.
- Wayne Gulliver, Christos C. Zouboulis, Gregor B. E. Jemec. "Evidence-based approach to the treatment of hidradenitis suppurativa/acne inversa, based on the European guidelines for hidradenitis suppurativa" (англ.) // Rev Endocr Metab Disord. — 2016. — Сентябрь (т. 17, № 3). — С. 343–351. — doi:10.1007/s11154-016-9328-5.
- Alan Menter, Stephen K. Tyring, Kenneth Gordon. "Adalimumab therapy for moderate to severe psoriasis: A randomized, controlled phase III trial" (англ.) // Journal of the American Academy of Dermatology. — 2008. — Январь (т. 58, № 1). — С. 106–15. — doi:10.1016/j.jaad.2007.09.010.
- Katherine F. Croom, Paul L. McCormack. "Adalimumab" (англ.) // American Journal of Clinical Dermatology. — 2009. — Т. 10, № 1. — С. 43–50. — doi:10.2165/0128071-200910010-00008.
- Richard B. Gearry, Christopher Frampton, Stephen Inns, David Poppelwell, Marius Rademaker, Ravi Suppiah. "VITALITY: impact of adalimumab on health and disability outcomes in patients with Crohn's disease, rheumatoid arthritis, or psoriasis treated in clinical practice in New Zealand" (англ.) // Current Medical Research and Opinion. — 2019. — 1 июля (т. 35, № 10). — С. 1837–1846. — ISSN 0300-7995. — doi:10.1080/03007995.2019.1634952.
- Daniel K. Podolsky. "Inflammatory bowel disease" (PDF) (англ.) // The New England Journal of Medicine (NEJM). — 2002. — Август (т. 347, № 6). — С. 417–29. — doi:10.1056/NEJMra020831.
- Maxwell L. J., Zochling J., Boonen A., Singh J. A., Veras M. M. "TNF-alpha inhibitors for ankylosing spondylitis" (англ.) // The Cochrane Database of Systematic Reviews. — 2015. — 1 апреля (т. 4, № 4). — doi:10.1002/14651858.CD005468.pub2.
- Beth Welch. "Adalimumab (Humira) for the Treatment of Rheumatoid Arthritis" (англ.) // American Family Physician. — 2008. — 1 декабря (т. 78, № 12). — С. 1406-1408. — ISSN 0002-838X.
- Laurent Peyrin-Biroulet, Silvio Danese, Fraser Cummings, Raja Atreya, Kay Greveson. "Anti-TNF biosimilars in Crohn's Disease: a patient-centric interdisciplinary approach" (англ.) // Expert Review of Gastroenterology & Hepatology. — 2019. — 2 июля (т. 13, № 8). — С. 731–738. — ISSN 1747-4124. — doi:10.1080/17474124.2019.
Дополнительные источники
- AusPAR: Adalimumab : [арх. 15 января 2021]. — September 2020.