Мышьяковая кислота
| Мышьяковая кислота | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
мышьяковая кислота |
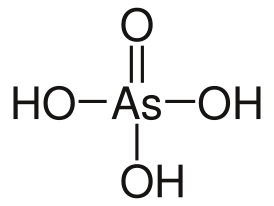
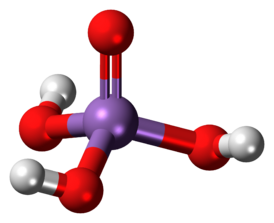
| Хим. формула | H3AsO4 |
| Рац. формула | H3AsO4 |
| Физические свойства | |
| Состояние | белые прозрачные кристаллы |
| Молярная масса | 141,94 г/моль |
| Плотность | 2,5 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 35,5 °C (308,65 K) |
| • разложения | ≥ 100 °C |
| Химические свойства | |
| Константа диссоциации кислоты [math]\displaystyle{ pK_a }[/math] | 6⋅10−3; 2⋅10−7; 3⋅10−12 |
| Растворимость | |
| • в воде | 16.7 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7778-39-4 |
| Безопасность | |
| Токсичность | Чрезвычайно ядовита |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Мышьяко́вая кислота́ — (ортомышьяковая кислота) [math]\ce{ H3AsO4{,} }[/math] трехосновная кислота средней силы. Легко растворима в воде, из растворов кристаллизуется в виде кристаллогидрата [math]\ce{ H3AsO4 . 0,5 H2O{.} }[/math]
Предполагается существование метамышьяковой ([math]\ce{ HAsO3 }[/math]) и пиромышьяковой ([math]\ce{ H4As2O7 }[/math]) кислот.
Кислота и её соли (арсенаты) ядовиты для человека в той или иной степени.
Свойства
Будучи трехосновной кислотой, диссоциирует в три ступени:
- [math]\ce{ H3AsO4 <=> H2AsO4^-\ +\ H^+{,} }[/math] K1 = 10−2,19;
- [math]\ce{ H2AsO4^- <=> HAsO4^{2-}\ +\ H^+{,} }[/math] K2 = 10−6,94;
- [math]\ce{ HAsO4^{2-} <=> AsO4^{3-}\ +\ H^+{,} }[/math] K3 = 10−11,5.
Образует средние соли арсенаты и кислые гидро- и дигидроарсенаты, по составу и растворимости соответствующие фосфатам.
Мышьяковая кислота обладает окислительными свойствами, которые проявляются лишь в кислой среде:
- [math]\ce{ H3AsO4 + 2HI -> H3AsO3 + I2 + H2O{.} }[/math]
Качественными реакциями на анион [math]\ce{ AsO4^{3-} }[/math] являются образование малорастворимых солей [math]\ce{ (NH4)MgAsO4 }[/math] и [math]\ce{ (NH4)3AsMo12O40.6H2O{,} }[/math] а также образование нерастворимой соли [math]\ce{ Ag3AsO4 }[/math] (ПР = 10−20), имеющей характерную окраску «кофе с молоком».
Получение
Мышьяковая кислота образуется при действии на [math]\displaystyle{ \mathsf{As_2O_3} }[/math] и [math]\displaystyle{ \mbox{As} }[/math] сильных окислителей, например азотной кислоты:
- [math]\ce{ 3 As2O3 + 4 HNO3 + 7 H2O -> 4 NO ^ + 6 H3AsO4{,} }[/math]
- [math]\ce{ As2O3 + 4 HNO3 + H2O -> 4 NO2 ^ + 2 H3AsO4{.} }[/math]
Также её можно получить при растворении в воде мышьякового ангидрида:
- [math]\ce{ As2O5 + 3 H2O -> 2 H3AsO4{.} }[/math]
Токсичность
Как и все неорганические соединения мышьяка, мышьяковая кислота H3AsO4 и многие её соли очень ядовиты в больших концентрациях.
Литература
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. М.: Химия 1994.
Ссылки
- [www.xumuk.ru/encyklopedia/2730.html xumuk.ru о мышьяковой кислоте]