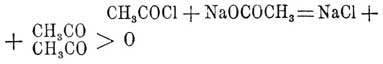Уксусный ангидрид — C4H6O3 = (СН3CO)2О — является представителем ангидридов органических жирных кислот формулы СnН2nО2. Он может быть получен в небольших количествах при действии фосфорного ангидрида на уксусную кислоту (Этар, Гал). Обыкновенно его получают так: при охлаждении по каплям прибавляют одну частицу хлористого ацетила к одной частице обезвоженного, тщательно высушенного уксусно-кислого натрия, продукт реакции некоторое время умеренно нагревают, образовавшийся У. ангидрид отгоняют на песчаной бане или прямо на голом огне и очищают перегонкой. Реакция его образования следующая:
(Канонников, Зайцев). У. ангидрид представляет сильно пахнущую уксусной кислотой жидкость с темп. кип. 137,9° и удельным весом 1,0969 при 0° и 1,0799 при 15°,2 (Копп). У. ангидрид растворяется в воде и сравнительно медленно разлагается, переходя в У. кислоту, при обыкновенной температуре. Скорость образования У. кислоты из У. ангидрида и воды была изучена Меншуткиным и Васильевым; она возрастает с увеличением массы воды, участвующей в реакции, и с повышением температуры. При равенстве частей воды и ангидрида при 19° через 6 час. около 50% ангидрида превращается в У. кислоту; оканчивается реакция только через 11 дней. Хлористый водород уже при обыкновенной темп. и очень энергично при 100° разлагает У. ангидрид на хлористый ацетил и У. кислоту:
(CH3СО)2О + HCl = СН3COCl + СН3COOH.
При действии на У. ангидрид брома и хлора образуются хлороуксусная кислота и хлористый ацетил:
(CH3СО)2О + Cl2 = СН3COCl + СН2ClCOOH (Гал).
При восстановлении цинковой пылью получается ацетон (Ян). При действии PCl5 образуется хлористый ацетил. Хлористый алюминий при нагревании с У. ангидридом разлагает его с образованием уксусно-кислого алюминия и хлористого ацетила. Высушенная уксусно-калиевая соль растворяется при 100° в У. ангидриде, и тогда образуется соединение, кристаллизующееся в иглах (C2H3O)2O + 2С2H3О2К. У. ангидрид может быть с успехом применяем для получения сложных эфиров (Жерар) различных спиртов по уравнению, например:
(С2Н3О)2О + 2С2Н5ОН = 2С2H3(C2H5)O2 + H2О.
Обыкновенно для ускорения реакции берут избыток У. ангидрида и ведут ее при названии в запаянной трубке при 100° в течение нескольких часов. Исследование скорости, с которой протекает эта реакция (Меншуткин), показывает, что изомерия алкоголей характерным образом влияет на скорость реакции: при одинаковых прочих условиях, первичные алкоголи представляют наибольшую скорость этерификация, третичные — наименьшую.