Цементит
| Цементит |
|---|
 |
| Фазы железоуглеродистых сплавов |
|
| Структуры железоуглеродистых сплавов |
|
| Стали |
| Чугуны |
|
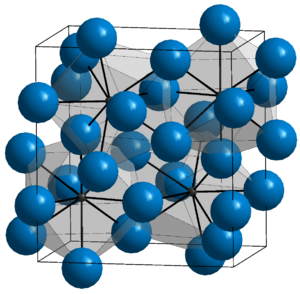
Цементит — карбид железа, химическое соединение с формулой Fe3C.
Описание
Концентрация углерода в цементите — 6,67% по массе — предельная для железоуглеродистых сплавов. Цементит — метастабильная фаза; образование стабильной фазы — графита во многих случаях затруднено. Цементит имеет орторомбическую кристаллическую решётку, очень твёрд и хрупок, слабо магнитен до 210 °C.
В зависимости от условий кристаллизации и последующей обработки цементит может иметь различную форму — равноосных зёрен, сетки по границам зёрен, пластин, а также видманштеттову структуру.
Цементит в разных количествах, в зависимости от концентрации, присутствует в железоуглеродистых сплавах уже при малых содержаниях углерода. Формируется в процессе кристаллизации из расплава чугуна. В сталях выделяется при охлаждении аустенита или при нагреве мартенсита. Цементит является фазовой и структурной составляющей железоуглеродистых сплавов, составной частью ледебурита, перлита, сорбита и троостита. Цементит — представитель так называемых фаз внедрения, соединений переходных металлов с лёгкими металлоидами. В фазах внедрения велики доля как ковалентной, так и металлической связи.
Твёрдость по Бринеллю больше 800 кг/мм2.
Первичный цементит кристаллизуется из жидкого сплава
Вторичный цементит - из аустенита
Третичный цементит - из феррита
Химические свойства
Серый, относительно твёрдый, термически устойчивый. Не реагирует с водой, щелочами, гидратом аммиака.
- разлагается при температуре выше 1650 °C:
- [math]\displaystyle{ \mathsf{Fe_3C \ \xrightarrow{\gt 1650^oC} 3Fe + C} }[/math]
- Разлагается кислотами (конц.):
- [math]\displaystyle{ \mathsf{Fe_3C + 6HCl \ \xrightarrow{} 3FeCl_2 + C{\downarrow} + 3H_2{\uparrow}} }[/math]
- [math]\displaystyle{ \mathsf{Fe_3C + 22HNO_3 \ \xrightarrow{} 3Fe(NO_3)_3 + CO_2{\uparrow} + +13NO_2{\uparrow} +11H_2O} }[/math]
- Реагирует с кислородом:
- [math]\displaystyle{ \mathsf{Fe_3C + 3O_2 \ \xrightarrow{600-700^oC} Fe_3O_4 + CO_2} }[/math]
- [math]\displaystyle{ \mathsf{4Fe_3C + Fe_3O_4 \ \xrightarrow{1000-1100^oC} 15Fe + 4CO} }[/math]
Литература
- Бунин К. П., Баранов А. А. Металлография. — М.: Металлурия, 1970.
- Уманский Я.С., Скаков Ю.А., Физика металлов, М., 1978.
- Кузьмин Б. А., Самохоцкий А. И., Кузнецова Т. Н. Металлургия, металловедение и конструкционные материалы. — М., "Высшая школа", 1971. — 352 с.
- Неорганическая химия в реакциях / Р.А.Лидин, В.А.Молочко, Л.Л.Андреева. — Москва: "Дрофа", 2007. — Т. 3. — 640 с. — ISBN 978-5-358-01303-2.