Устойчивость к антимикотикам
Усто́йчивость (резисте́нтность) к противогрибко́вым препара́там — отсутствие фунгистатического или фунгицидного действия антимикотика на грибок. Устойчивость к действию противогрибковых лекарственных препаратов первой линии обнаружена у всех основных возбудителей глубоких и поверхностных микозов человека, включая Candida spp., Aspergillus spp.[1], Cryptococcus spp.[2], Trichophyton spp.[3], но её распространенность варьирует в разных странах. Устойчивость входит в число факторов, влияющих на эффективность противогрибковой терапии, наряду с наличием фоновых заболеваний, комплаентностью пациента, индивидуальными особенностями иммунной системы пациента и качеством лекарственного препарата.
Терминология
Если геном гриба содержит мутации, обусловливающие снижение эффективности антимикотика, говорят о его микробиологической устойчивости. Под эпидемиологическим пороговым значением (англ. epidemiological cut-off value, ECOFF) понимается такая концентрация антимикотика, которая позволяет отделить штаммы дикого типа от мутантных штаммов. Клиническая устойчивость — это способность грибка выживать и размножаться под действием терапевтических доз антимикотиков, что in vivo выражается в неэффективности противогрибковой терапии[4].

Дифференциация штаммов и видов грибков на чувствительные и устойчивые при оценке как микробиологической, так и клинической устойчивости к антимикотикам производится с помощью оценки минимальных пороговых концентраций. Минимальная пороговая концентрация (МПК) — это минимальная концентрация антимикотика, которая приводит к ингибированию роста грибка в эксперименте in vitro. Ингибирование роста грибков при достижении МПК антимикотика (фунгистатический эффект) не говорит о наличии у антимикотика в искомой концентрации фунгицидного эффекта. Для оценки последнего необходимо определение минимальной фунгицидной концентрации, которая зачастую превышает МПК. Наличие клинической устойчивости у изолята оценивают сравнивая МПК антимикотика с клиническими пороговыми значениями (англ. clinical breakpoint, CBP). Клинические пороговые значения устанавливаются путем соотнесения МПК лекарственного средства для определённого инфекционного агента с его фармакокинетикой и реальным клиническим опытом[5].
Понятия клинической и микробиологической устойчивости грибков к антимикотикам не являются синонимичными: так, некоторые мутантные штаммы, несущие в себе генетические детерминанты резистентности, могут фенотипически не проявлять достаточного повышения уровня устойчивости, выраженного в МПК, что будет характеризовать штамм как клинически чувствительный. Также, в экспериментальной науке под устойчивостью иногда понимают способность изолята грибка к росту в присутствии такой концентрации противогрибкового лекарственного средства, которая ингибирует рост других изолятов того же вида[6].
Определение чувствительности к антимикотикам
Для ручного определения чувствительности используют три основных метода: диск-диффузионный метод, метод серийных разведений и Etest. Также существуют автоматизированные системы, позволяющие определять чувствительность дрожжей, например, Vitek 2 (биоМерье), или дрожжей и плесневых грибов, например, Sensititre (БиоВитрум). Разработкой стандартов тестирования на чувствительность к антимикотикам занимаются в Европейском комитете по тестированию чувствительности к противомикробным препаратам (EUCAST) и Институте клинических и лабораторных стандартов (CLSI). Поскольку активность антимикотиков в отношении различных микромицетов варьирует, во многих случаях можно надежно предсказать устойчивость возбудителя, выяснив его видовую принадлежность.
Природная устойчивость
Генетические линии грибов, независимо от их таксономического статуса, — родового, видового или внутривидового, могут характеризоваться различными уровнями чувствительности к антимикотикам. Например, Clavispora lusitaniae дикого типа чувствительна к повышенным дозировкам флуконазола, а Candida (Clavispora) auris, как правило, — нет[7]. Природную устойчивость последней удается объяснить наличием определённых аминокислот в консервативных участках Erg11, которые у изолятов Candida albicans появляются только вследствие адаптации к лекарству[8]. Внесение в геном чувствительного к флуконазолу и вориканазолу Aspergillus fumigatus последовательности CYP51A мукорового гриба Rhizopus arrhizus приводит к развитию у аспергилла устойчивости, свойственной ризопусу[9]. Поэтому природную устойчивость Rhizopus arrhizus к этим азолам можно связать с особенностями структуры Cyp51A. Для одной из клональных линий C. albicans, выявляемой методом мультилокусного секвенирования-типирования, показана ассоциация с устойчивостью к фторцитозину и тербинафину[10]. Для комплекса видов Trichophyton mentagrophytes / Т. interdigitale известно около 15 генотипов региона ITS, но в подавляющем большинстве случаев устойчивость наблюдается у изолятов Тип VIII[11].
Механизмы возникновения устойчивости
Развитие устойчивости к антимикотикам происходит вследствие накопления мутаций в геноме микромицета под селективным давлением противогрибкового препарата. Спектры таких мутаций различны для каждого класса антимикотиков. Изоляты чувствительного генотипа могут приобретать устойчивый фенотип при вхождении в состав биопленки[12].
Устойчивость к азолам
Механизмы возникновения устойчивости к азолам лучше всего изучены у Candida albicans[13], но весьма вероятно, что первые два из перечисленных далее являются общими для всех грибов, значимых для медицины[14][15].
Активный экспорт: азолы могут быть удалены из клетки за счет повышения экспрессии мембранных переносчиков, что препятствует достижению концентрации лекарственного средства, достаточной для успешного ингибирования Erg11. В этом процессе участвуют два семейства переносчиков: облегчающие транспорт факторы MFS (например, MDR1), и ABC-транспортеры (например, CDR1 и CDR2). Повышение экспрессии генов, кодирующих мембранные переносчики, происходит вследствие мутаций в генах транскрипционных факторов. Интересно, что эксперименты с изолятами дикого типа, принадлежащими к комплексу видов C. haemulonii, не выявили повышения экспрессии генов мембранных насосов в присутствии флуконазола или вориконазола[16].
Модификация мишени: ген ERG11 может мутировать таким образом, что кодируемая им ланостерол 14α-деметилаза теряет сродство к азолам. По состоянию на 2010 год, для не менее чем 9 аминокислотных замен в белке Erg11 был экспериментально доказан вклад в развитие устойчивости к азолам, при помощи а) наблюдения повышенной МПК после экспрессии гетерологичного гена в дрожжах Saccharomyces cerevisiae посредством сайт-направленного мутагенеза, б) функциональной экспрессии ERG11, амплифицированного из C. albicans, в) выявления сниженного сродства ланостерол 14α-деметилазы к азолу[17]. У грибов рода Aspergillus, ген ланостерол 14α-деметилазы обозначают как CYP51. Aspergillus fumigatus обладает двумя его паралогами, CYP51A и CYP51B, развитие устойчивости происходит вследствие накопления мутаций в CYP51A и увеличения количества нуклеотидных повторов в его промоторе[18]. В геноме A. flavus присутствуют три паралога CYP51, мутации, потенциально обусловливающие устойчивость, обнаруживаются в CYP51A и CYP51C[19].
Повышение экспрессии гена мишени азолов, ланостерол 14α-деметилазы, может привести к тому, что достижение ингибирующей рост штамма концентрации антимикотика станет невозможным, и синтез эргостерола будет продолжаться. Происходит вследствие мутаций в гене соответствующего транскрипционного фактора, увеличивающих сродство самой регуляторной молекулы к энхансеру гена ERG11.
Отсутствие токсичного промежуточного продукта: при ингибировании Erg11 в клетке происходит накопление метилированного промежуточного соединения, 14α-метилфекостерола. Это соединение используется в качестве субстрата Δ5-6-десатуразой Erg3, с образованием токсичного продукта. Обнаружены штаммы с гомозиготными мутациями гена ERG3, обусловливающими потерю функциональности белком Erg3. Следовательно, эти штаммы не превращают метилированные соединения в токсичные соединения, что объясняет их устойчивость к азолам[20]. Это отсутствие функционального Erg3 обычно сочетается с устойчивостью к амфотерицину B, поскольку отсутствие Δ5-6-десатуразы перекрывает путь биосинтеза эргостерола.
Потеря гетерозиготности. У диплоидных дрожжей рода Candida мутации, обусловливающие возникновение устойчивости, могут появляться в одной хромосоме из двух гомологичных. При потере гетерозиготности, аллель с детерминантой устойчивости оказывается в гомозиготном состоянии, и его эффект усиливается[21].
Анеуплоидии. Устойчивые к азолам изоляты дрожжей часто имеют аберрантный кариотип[22][23]. В исследовании 2015 года у клинических изолятов C. albicans, полученных от больных с кандидозом полости рта, хромосомные перестройки были нестабильными. Достоверная корреляция с уровнем устойчивости к азолам отсутствовала[21]. Однако в более поздней работе 2021 года у одного из изученных штаммов C. auris дупликация сегмента хромосомы 1, содержащей ERG11, была единственной мутацией, которой можно было бы объяснить повышенную МПК флуконазола. У другого штамма дупликация всей хромосомы 5, содержащей ген транскрипционного фактора TAC1b, была единственным возможным объяснением 32-кратного повышения МПК флуконазола[24]. В экспериментах по культивированию Cryptococcus neoformans в присутствии флуконазола была показана корреляция числа дисомий нескольких различных хромосом с МПК лекарства. После переноса штаммов в среду, не содержащую флуконазола, дополнительные копии хромосом терялись и первоначальная чувствительность к флуконазолу восстанавливалась[25].
Образование биопленок. Нахождение в составе биопленок сопровождается рядом обратимых эффектов.
- Активный экспорт. В экспериментах in vitro, на ранних этапах развития биопленок происходит физиологическое повышение экспрессии генов мембранных насосов[26].
- Чувство кворума. Фарнезол, соединение, блокирующее образование псевдогиф C. albicans и способствующее переходу этих дрожжей в планктонную форму, снижает экспорт азолов из грибной клетки[27].
- Связывание азолов. В экспериментах с использованием радиоактивной метки было показано, что внеклеточный матрикс биопленок связывает азолы. Компонентом матрикса, ответственным за это, является β-1,3 глюкан[28].
- Покоящиеся клетки (англ. persister cells) — часть популяции клеток биопленки, характеризующиеся сниженной чувствительностью к нескольким классам лекарственных средств, остающаяся жизнеспособной после воздействия антимикотиком. Она способна восстановить биопленку с тем же процентом устойчивых клеток (0,01—0,02 %), который наблюдался изначально[13].
Устойчивость к аллиламинам
В 2020 году микробиологическую устойчивость к тербинафину, как правило, связывают с мутациями в гене эпоксидазы сквалена ERG1. Несмотря на это, часть устойчивых изолятов имеет последовательность ERG1 дикого типа, поэтому имеют место и другие механизмы возникновения устойчивости к данному антимикотику[11].
Устойчивость к эхинокандинам
Мишенью эхинокандинов является фермент β-1,3-D-глюкан синтаза, отвечающая за синтез компонента клеточной стенки. Устойчивость к эхинокандинам развивается за счет появления аминокислотных замен в данном ферменте, причем у грибов рода Candida основная часть изменений ограничена двумя участками полипептида, так называемыми «горячими точками»[29].
Факторы, влияющие на возникновение устойчивости
К причинам возникновения устойчивости относят несистематическое применение противогрибковых лекарственных средств. Отклонение от дозировки и режима приема препарата, оптимизированных для достижения клинического эффекта, дает грибу возможность приспособиться к существованию в присутствии лекарства. Основным механизмом возникновения точечных мутаций являются ошибки ДНК-полимераз, и высокая численность популяции активно делящихся клеток гриба ассоциирована с высокой вероятностью развития устойчивости. Поэтому хронический аспергиллез легких, при котором возможно спороношение, с большей вероятностью будет осложнен лекарственной устойчивостью по сравнению с внелегочными формами[30]. Поскольку инородные тела в человеческом организме являются хорошим субстратом для роста биопленок, в течение первых 24 часов с момента выявления кандидемии рекомендуется удаление или замена внутрисосудистых катетеров[31].
Противогрибковые средства не увеличивают скорость мутационного процесса, так как отсутствие мутагенного эффекта является обязательным условием выпуска на рынок любого лекарственного препарата. Поэтому (1) мутации в геноме грибка происходят спонтанно; (2) далее происходит избирательное размножение носителей мутаций, благоприятствующих выживанию[32].
Эпидемиология
Если устойчивость бактерий отчасти определяется генами, располагающимися на плазмидах и иных мобильных генетических элементах, то для грибов это не характерно. Также, горизонтальный перенос генов у грибов редок[33][34]. Поэтому резистентность грибов распространяется исключительно с устойчивыми штаммами. Вопрос о передаче устойчивых штаммов Candida spp. от человека к человеку при половом контакте является спорным[35][36], но возможность заражения новорожденного ребёнка от матери хорошо установлена[37]. То же самое относится и к Trichophyton spp., передающимся половым путем[38]. Поскольку значительная часть противогрибковых препаратов сходна по химическому строению с сельскохозяйственными фунгицидами, источником устойчивых изолятов при поражениях легких, вызванных плесневыми грибами, могут быть сельскохозяйственные угодья[39].
Сопутствующие явления
Мутационные изменения, направленные на повышение устойчивости грибка к антимикотикам, могут приводить к повышению его вирулентности. Так, мутации в гене транскрипционного фактора PDR1, отвечающие за повышение экспрессии генов мембранных насосов у Candida glabrata, были ассоциированы со снижением эффективности поглощения дрожжевых клеток макрофагами[40].
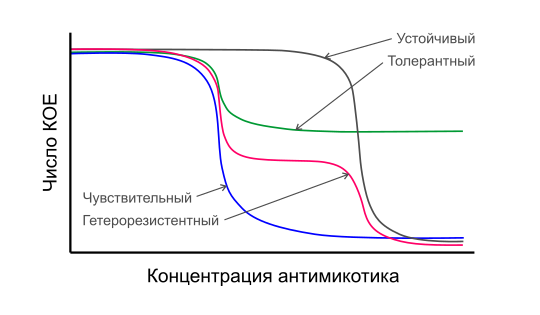
При тестировании изолятов микромицетов на чувствительность in vitro можно наблюдать несколько необычных явлений. Противогрибковая толерантность является характеристикой чувствительных к лекарствам штаммов, которые обладают способностью медленно расти при ингибирующих концентрациях лекарственного средства; обычно только некоторые из клеток данной популяции демонстрируют этот медленный рост[6]. То же самое, что и следовой рост (англ. trailing growth)[41]. Гетерорезистентность — клинический термин для изолятов, содержащих небольшие субпопуляции клеток (обычно <1 %), которые обладают способностью расти при концентрациях лекарственного средства, по крайней мере в восемь раз превышающих МПК для подавляющего большинства чувствительных клеток в популяции. Парадоксальный рост — способность грибкового изолята восстанавливать рост в присутствии высоких концентраций лекарственного средства, но быть полностью чувствительным при более низких концентрациях. Парадоксальный рост появляется с задержкой от одного до нескольких дней, но напоминает рост при отсутствии препарата. Сообщалось о парадоксальном росте в первую очередь в присутствии эхинокандинов. По состоянию на 2020 год, клиническая значимость и молекулярные механизмы данных явлений оставались малоизученными[6].
Детерминанты устойчивости и лабораторная диагностика
Механизмы приобретенной устойчивости к наиболее распространенным антимикотикам многообразны, это препятствует разработке тест-систем для молекулярной диагностики. Однако существуют несколько схем ПЦР для выявления мутаций в генах FKS1 и FKS2 изолятов C. glabrata, обусловливающих устойчивость к эхинокандинам[42]. Кроме того, предложена ПЦР тест-система для выявления мутации в ERG1, отвечающей за устойчивость T. mentagrophytes к тербинафину[43]. Для Aspergillus fumigatus есть пример того, как открытие новых механизмов устойчивости[44] поставило под вопрос применимость ранее разработанной тест-системы, ориентированной на непосредственное выявление функциональных мутаций[45].
См. также
Примечания
- ↑ (2020) «The quiet and underappreciated rise of drug-resistant invasive fungal pathogens». Journal of Fungi 6 (3): E138. doi:10.3390/jof6030138. PMID 32824785.
- ↑ (2020) «A titanic drug resistance threat in Cryptococcus neoformans». Current Opinion in Microbiology 52: 158—164. doi:10.1016/j.mib.2019.11.001. PMID 31765991.
- ↑ (2020) «MIC and upper limit of wild-type distribution for 13 antifungal agents against a Trichophyton mentagrophytes-Trichophyton interdigitale complex of Indian origin». Antimicrobial Agents and Chemotherapy 64 (4): e01964-19. doi:10.1128/AAC.01964-19. PMID 32015042.
- ↑ The European Committee on Antimicrobial Susceptibility Testing. www.eucast.org. Дата обращения: 8 сентября 2020. Архивировано 4 сентября 2020 года.
- ↑ (2001) «Establishing MIC breakpoints and the interpretation of in vitro susceptibility tests». Journal of Antimicrobial Chemotherapy 48 Suppl 1: 17—28. doi:10.1093/jac/48.suppl_1.17. PMID 11420334.
- ↑ 6,0 6,1 6,2 (2020) «Drug resistance and tolerance in fungi». Nature Reviews Microbiology 18 (6): 319—331. doi:10.1038/s41579-019-0322-2. PMID 32047294.
- ↑ Чем нас лечат: Candida auris. Чем опасен и как с ним бороться. https://indicator.ru/. Дата обращения: 23 ноября 2020. Архивировано 30 ноября 2020 года.
- ↑ (2017) «Simultaneous emergence of multidrug-resistant Candida auris on 3 continents confirmed by whole-genome sequencing and epidemiological analyses». Clinical Infectious Diseases 64 (2): 134—140. doi:10.1093/cid/ciw691. PMID 27988485.
- ↑ (2018) «Molecular confirmation of the linkage between the Rhizopus oryzae CYP51A gene coding region and its intrinsic voriconazole and fluconazole resistance». Antimicrobial Agents and Chemotherapy 62 (8): e00224-18. doi:10.1128/AAC.00224-18. PMID 29891608.
- ↑ (2010) «Molecular phylogenetics and epidemiology of Candida albicans». Future Microbiology 5 (1): 67—79. doi:10.2217/fmb.09.113. PMID 20020830.
- ↑ 11,0 11,1 (2020) «Emergence of terbinafine resistant Trichophyton mentagrophytes in Iran, harboring mutations in the squalene epoxidase (SQLE) gene». Infection and Drug Resistance 13: 845—850. doi:10.2147/IDR.S246025. PMID 32214830.
- ↑ (2019) «Biofilms and vulvovaginal candidiasis». Colloids and Surfaces B: Biointerfaces 174: 110—125. doi:10.1016/j.colsurfb.2018.11.011. PMID 30447520.
- ↑ 13,0 13,1 Candida albicans: cellular and molecular biology. — 2nd ed. — Springer, 2017. — P. 554. — ISBN 978-3-319-50409-4.
- ↑ (2016) «Epidemiology and molecular mechanisms of antifungal resistance in Candida and Aspergillus». Mycoses 59 (4): 198—219. doi:10.1111/myc.12469. PMID 26810669.
- ↑ (2019) «Trichophyton rubrum azole resistance mediated by a new ABC transporter, TruMDR3». Antimicrobial Agents and Chemotherapy 63 (11): e00863-19. doi:10.1128/AAC.00863-19. PMID 31501141.
- ↑ (2020) «Insights into the multi-azole resistance profile in Candida haemulonii species complex». Journal of Fungi 6 (4): E215. doi:10.3390/jof6040215. PMID 33050545.
- ↑ (2010) «Screening for amino acid substitutions in the Candida albicans Erg11 protein of azole-susceptible and azole-resistant clinical isolates: new substitutions and a review of the literature». Diagnostic Microbiology and Infectious Disease 66 (4): 373—384. doi:10.1016/j.diagmicrobio.2009.11.006. PMID 20226328.
- ↑ (2015) «Triazole resistance in Aspergillus species: an emerging problem». Drugs 77 (6): 599—613. doi:10.1007/s40265-017-0714-4. PMID 28236169.
- ↑ (2020) «Point mutations in the 14-α sterol demethylase Cyp51A or Cyp51C could contribute to azole resistance in Aspergillus flavus». Genes (Basel) 11 (10): 1217. doi:10.3390/genes11101217. PMID 33080784.
- ↑ (2012) «Amino acid substitutions in the Candida albicans sterol Δ5,6-desaturase (Erg3p) confer azole resistance: characterization of two novel mutants with impaired virulence». Journal of Antimicrobial Chemotherapy 67 (9): 2131—2138. doi:10.1093/jac/dks186. PMID 22678731.
- ↑ 21,0 21,1 (2015) «The evolution of drug resistance in clinical isolates of Candida albicans». Elife 4: e00662. doi:10.7554/eLife.00662. PMID 25646566.
- ↑ (2006) «Aneuploidy and isochromosome formation in drug-resistant Candida albicans». Science 313 (5785): 367–370. doi:10.1126/science.1128242. PMID 16857942.
- ↑ (2011) «Deletion of Cryptococcus neoformans AIF ortholog promotes chromosome aneuploidy and fluconazole-resistance in a metacaspase-independent manner». PLoS Pathogens 7 (11): e1002364. doi:10.1371/journal.ppat.1002364. PMID 22114551.
- ↑ (2021) «Genome-wide analysis of experimentally evolved Candida auris reveals multiple novel mechanisms of multidrug resistance». mBio 12 (2): e03333-20. doi:10.1128/mBio.03333-20. PMID 33820824.
- ↑ (2010) «Cryptococcus neoformans overcomes stress of azole drugs by formation of disomy in specific multiple chromosomes». PLoS Pathogens 6 (4): e1000848. doi:10.1371/journal.ppat.1000848. PMID 20368972.
- ↑ (2002) «Investigation of multidrug efflux pumps in relation to fluconazole resistance in Candida albicans biofilms». Journal of Antimicrobial Chemotherapy 49 (6): 973–980. doi:10.1093/jac/dkf049. PMID 12039889.
- ↑ (2011) «The quorum-sensing molecule farnesol is a modulator of drug efflux mediated by ABC multidrug transporters and synergizes with drugs in Candida albicans». Antimicrobial Agents and Chemotherapy 55 (10): 4834–4843. doi:10.1128/AAC.00344-11. PMID 21768514.
- ↑ (2010) «Genetic basis of Candida biofilm resistance due to drug-sequestering matrix glucan». The Journal of Infectious Diseases 202 (1): 171–175. doi:10.1086/651200. PMID 20497051.
- ↑ (2015) «Mechanisms of echinocandin antifungal drug resistance». Annals of the New York Academy of Sciences 1354 (1): 1—11. doi:10.1111/nyas.12831. PMID 26190298.
- ↑ (2016) «In-host adaptation and acquired triazole resistance in Aspergillus fumigatus: a dilemma for clinical management». The Lancet Infectious Diseases 16 (11): e251-e260. doi:10.1016/S1473-3099(16)30138-4. PMID 27638360.
- ↑ Диагностика и лечение микозов в отделениях реанимации и интенсивной терапии: Российские рекомендации. — М : Фармтек, 2015. — P. 96. — ISBN 978-5-86765-501-3.
- ↑ Основы мутагенеза и генотоксикологии. Лекции: учебное пособие. — М; СПб : Нестор-История, 2012. — P. 148. — ISBN 978-5-905986-98-7.
- ↑ (2012) «Horizontal gene transfer in fungi». FEMS Microbiology Letters 329 (1): 1-8. doi:10.1111/j.1574-6968.2011.02465.x. PMID 22112233.
- ↑ Bredeweg, Erin L. Horizontal Gene Transfer in Fungi // Grand Challenges in Fungal Biotechnology / Erin L Bredeweg, Scott E Baker. — Cham : Springer, 2020. — P. 317-332. — ISBN 978-3-030-29541-7.
- ↑ (2008) «Vulvovaginal candidiasis in women who have sex with women». Sexually Transmitted Diseases 35 (6): 533—536. doi:10.1097/OLQ.0b013e31816766c2. PMID 18418293.
- ↑ (2014) «Lack of evidence for sexual transmission of genital Candida species among women who have sex with women: a mixed methods study». Sexually Transmitted Infections 90 (2): 165—170. doi:10.1136/sextrans-2013-051361. PMID 24431188.
- ↑ (2014) «The effect of maternal flora on Candida colonisation in the neonate». Mycoses 57 (1): 43—48. doi:10.1111/myc.12100. PMID 23758480.
- ↑ (2015) «Tinea genitalis: a new entity of sexually transmitted infection? Case series and review of the literature». Sexually Transmitted Infections 91 (7): 493—496. doi:10.1136/sextrans-2015-052036. PMID 26071391.
- ↑ (2017) «The global problem of antifungal resistance: prevalence, mechanisms, and management». The Lancet Infectious Diseases 17 (12): e383-e392. doi:10.1016/S1473-3099(17)30316-X. PMID 28774698.
- ↑ (2013) «Gain-of-function mutations in PDR1, a regulator of antifungal drug resistance in Candida glabrata, control adherence to host cells». Infection and Immunity 81 (5): 1709—1720. doi:10.1128/IAI.00074-13. PMID 23460523.
- ↑ (2016) «In vitro susceptibility and trailing growth effect of clinical isolates of Candida species to azole drugs». Jundishapur Journal of Microbiology 9 (2): e28666. doi:10.5812/jjm.28666. PMID 27127587.
- ↑ (2016) «Rapid detection of FKS-associated echinocandin resistance in Candida glabrata». Antimicrobial Agents and Chemotherapy 60 (11): 6573—6577. doi:10.1128/AAC.01574-16. PMID 27550360.
- ↑ (2020) «Rapid detection of terbinafine resistance in Trichophyton species by Amplified refractory mutation system-polymerase chain reaction». Scientific Reports 10 (1): 1297. doi:10.1038/s41598-020-58187-0. PMID 31992797.
- ↑ (2019) «Genomic perspective of triazole resistance in clinical and environmental Aspergillus fumigatus isolates without cyp51A mutations». Fungal Genetics and Biology 132: 103265. doi:10.1016/j.fgb.2019.103265. PMID 31465846.
- ↑ (2019) «A simple and low cost tetra-primer ARMS-PCR method for detection triazole-resistant Aspergillus fumigatus». Molecular Biology Reports 46 (4): 4537—4543. doi:10.1007/s11033-019-04909-1. PMID 31214961.
