Предел Хейфлика
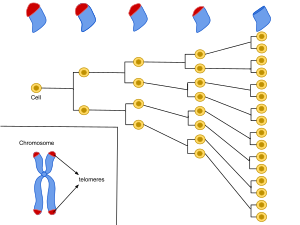
Предел или лимит Хейфлика (англ. Hayflick limit) — граница количества делений соматических клеток, названа в честь её открывателя Леонарда Хейфлика. В 1961[1] году Хейфлик наблюдал, как клетки человека, делящиеся в клеточной культуре, умирают приблизительно после 50 делений и проявляют признаки старения при приближении к этой границе.
Данная граница была найдена в культурах соматических клеток как человека, так и других многоклеточных организмов. Максимальное число делений клетки различно в зависимости от её типа и ещё сильнее различается в зависимости от организма, которому эта клетка принадлежит. Для большинства человеческих клеток предел Хейфлика составляет 52 деления.
Граница Хейфлика связана с сокращением размера теломер, участков ДНК на концах хромосом. Как известно, молекула ДНК способна к репликации перед каждым делением клетки. При этом имеющиеся у неё на концах теломеры после каждого деления клетки укорачиваются. Теломеры человека в лимфоцитах периферической крови укорачиваются со скоростью примерно 70 пар нуклеотидов в год, в то время как теломеры мышей укорачиваются со скоростью 7000 пар нуклеотидов в год. При этом люди имеют относительно короткие теломеры длиной от 5 до 15 тысяч пар нуклеотидов, а у мышей длина теломер может составлять около 50 тысяч пар нуклеотидов[2].
В клетке существует фермент теломераза, активность которого может обеспечивать удлинение теломер, при этом удлиняется и жизнь клетки. Клетки, в которых функционирует теломераза (половые, раковые), бессмертны. В обычных (соматических) клетках, из которых в основном и состоит организм, теломераза «не работает», поэтому теломеры при каждом делении клетки укорачиваются, что в конечном счёте приводит к её гибели в пределах лимита Хейфлика, потому что другой фермент — ДНК-полимераза — не способен реплицировать концы молекулы ДНК.
В настоящее время предложена эпигенетическая теория старения, которая объясняет эрозию теломер прежде всего активностью клеточных рекомбиназ, активизирующихся в ответ на повреждения ДНК, вызванные, главным образом, возрастной депрессией мобильных элементов генома[3]. Когда после определённого числа делений теломеры исчезают совсем, клетка замирает в определённой стадии клеточного цикла или запускает программу апоптоза — открытого во второй половине XX века явления планового разрушения клетки, проявляющегося в уменьшении размера клетки и минимизации количества вещества, попадающего в межклеточное пространство после её разрушения.
Принцип эксперимента
Принципиально, эксперимент проведённый Леонардом Хейфликом в сотрудничестве с Полом Мурхедом, был довольно простым: смешивали равные части нормальных мужских и женских фибробластов, различавшихся по количеству пройденных клеточных делений (мужские — 40 делений, женские — 10 делений) для того, чтобы фибробласты можно было отличить друг от друга в дальнейшем. Параллельно был поставлен контроль с мужскими 40-дневными фибробластами. Когда же контрольная несмешанная популяция мужских клеток перестала делиться, то смешанная опытная культура содержала только женские клетки, ведь все мужские клетки уже погибли[4]. На основании этого Хейфлик сделал вывод, что нормальные клетки имеют ограниченную способность к делению в отличие от раковых клеток, которые бессмертны[5]. Так было выдвинуто предположение, что так называемые «митотические часы» находятся внутри каждой клетки, на основании следующих наблюдений:
- Нормальные фетальные фибробласты человека в культуре способны удваивать популяцию только ограниченное количество раз;
- Клетки, которые подверглись криогенной обработке, «помнят», сколько раз они делились до заморозки.
Биологический смысл явления
В настоящее время главенствует точка зрения, связывающая лимит Хейфлика с проявлением механизма подавления опухолеобразования, возникшего у многоклеточных организмов. Другими словами, опухолесупрессорные механизмы, такие как репликативное старение и апоптоз, бесспорно полезны в раннем онтогенезе и зрелости, но побочно являются причиной старения[6][7] — ограничивают продолжительность жизни в результате накопления дисфункциональных стареющих клеток или избыточной гибели функциональных[8].
См. также
Примечания
- ↑ Hayflick L., Moorhead P.S. The serial cultivation of human diploid cell strains Архивная копия от 18 мая 2012 на Wayback Machine // Exp. Cell Res., 1961, v. 253, p. 585—621.
- ↑ Whittemore K. et al. Telomere shortening rate predicts species life span (англ.) // Proceedings of the National Academy of Sciences. — 2019. — Vol. 116, no. 30. — P. 15122-15127. — doi:10.1073/pnas.1902452116.
- ↑ Галицкий В.А. Эпигенетическая природа старения (рус.) // Цитология. — 2009. — Т. 51. — С. 388—397. Архивировано 15 июня 2013 года.
- ↑ L. Hayflick, P. S. Moorhead. The serial cultivation of human diploid cell strains // Experimental Cell Research. — 1961-12-01. — Т. 25. — С. 585—621. — ISSN 0014-4827. Архивировано 20 декабря 2016 года.
- ↑ J. W. Shay, W. E. Wright. Hayflick, his limit, and cellular ageing // Nature Reviews. Molecular Cell Biology. — 2000-10-01. — Т. 1, вып. 1. — С. 72—76. — ISSN 1471-0072. — doi:10.1038/35036093. Архивировано 20 декабря 2016 года.
- ↑ Judith Campisi, Fabrizio d'Adda di Fagagna. Cellular senescence: when bad things happen to good cells // Nature Reviews. Molecular Cell Biology. — 2007-09-01. — Т. 8, вып. 9. — С. 729—740. — ISSN 1471-0080. — doi:10.1038/nrm2233. Архивировано 20 декабря 2016 года.
- ↑ Margaret A. Keyes, Eduardo Ortiz, Deborah Queenan, Ronda Hughes, Francis Chesley. A Strategic Approach for Funding Research: The Agency for Healthcare Research and Quality's Patient Safety Initiative 2000-2004 // Advances in Patient Safety: From Research to Implementation (Volume 4: Programs, Tools, and Products) / Kerm Henriksen, James B. Battles, Eric S. Marks, David I. Lewin. — Rockville (MD): Agency for Healthcare Research and Quality (US), 2005-01-01. Архивировано 11 июня 2018 года.
- ↑ Marlys Hearst Witte, Moriya Ohkuma, Mauro Andrade, Corradino Campisi, Franccesco Boccardo. Nature's historic gap: the 20th century of lymphology // Lymphology. — 2005. — 1 декабря (т. 38, вып. 4). — С. 157—158. — ISSN 0024-7766. — PMID 16515223. Архивировано 20 декабря 2016 года.
Литература
- Хейфлик Л. Как и почему мы стареем? : Советы специалиста / Леонард Хейфлик. — М.: Вече; АСТ, 1999. — 432 с. — (Ваше здоровье). — ISBN 5-7838-0435-5.
Ссылки
- Medical research: Cell division Архивная копия от 20 июня 2017 на Wayback Machine / Nature 498, 422—426 (27 June 2013) doi:10.1038/498422a (англ.)