Метаарсенит натрия
Внешний вид
| Метаарсенит натрия | |
|---|---|
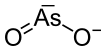  | |
| Общие | |
| Систематическое наименование |
Метаарсенит натрия |
| Традиционные названия | Метаарсенат(III) натрия, мышьяковистокислый (мета) натрий |
| Хим. формула | NaAsO2 |
| Физические свойства | |
| Молярная масса | 129,90 г/моль |
| Плотность | 1,87 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | разл. 550 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 15625 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7784-46-5 |
| PubChem | 443495 |
| Безопасность | |
| ЛД50 | 40 мг/кг |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Метаарсенит натрия — неорганическое соединение, соль щелочного металла натрия и метамышьяковистой кислоты с формулой NaAsO2, бесцветные кристаллы, растворимые в воде.
Получение
- Растворение мышьяка в кипящем растворе едкого натра:
- [math]\displaystyle{ \mathsf{2As + 2NaOH + 2H_2O \ \xrightarrow{100^oC}\ 2NaAsO_2 + 3H_2\uparrow } }[/math]
- Растворение триоксида мышьяка в разбавленном растворе щёлочи:
- [math]\displaystyle{ \mathsf{As_2O_3 + 2NaOH \ \xrightarrow{}\ 2NaAsO_2 + H_2O } }[/math]
- или концентрированном растворе карбоната натрия:
- [math]\displaystyle{ \mathsf{As_2O_3 + Na_2CO_3 \ \xrightarrow{100^oC}\ 2NaAsO_2 + CO_2\uparrow } }[/math]
Физические свойства
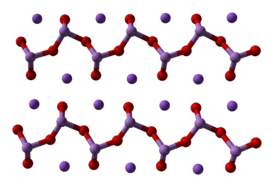
Метаарсенит натрия образует бесцветные кристаллы в котором анионы AsO2— образуют бесконечные цепочки.
Хорошо растворяется в холодной воде с частичным гидролизом по аниону.
Химические свойства
- При нагревании разлагается (диспропорционирует):
- [math]\displaystyle{ \mathsf{5NaAsO_2 \ \xrightarrow{300-550^oC}\ Na_3AsO_4 + 2NaAsO_3 + 2As } }[/math]
- Разлагается горячей водой с образованием дигидроарсенита натрия:
- [math]\displaystyle{ \mathsf{NaAsO_2 + H_2O \ \xrightarrow{100^oC}\ NaH_2AsO_3 } }[/math]
- Медленно окисляется кислородом воздуха:
- [math]\displaystyle{ \mathsf{2NaAsO_2 + O_2 \ \xrightarrow{}\ 2NaAsO_3 } }[/math]
- В щелочных растворах окисление идёт иначе:
- [math]\displaystyle{ \mathsf{2NaAsO_2 + O_2 + 2NaOH \ \xrightarrow{CuSO_4}\ 2Na_2HAsO_4 } }[/math]
- Реагирует в разбавленными кислотами:
- [math]\displaystyle{ \mathsf{2NaAsO_2 + 2HCl \ \xrightarrow{}\ As_2O_3\downarrow + 2NaCl + H_2O } }[/math]
- и концентрированными:
- [math]\displaystyle{ \mathsf{NaAsO_2 + 4HCl \ \xrightarrow{}\ AsCl_3 + NaCl + 2H_2O } }[/math]
- Реагирует с щелочами с образованием гидроарсенита натрия:
- [math]\displaystyle{ \mathsf{NaAsO_2 + NaOH \ \xrightarrow{}\ Na_2HAsO_3 } }[/math]
- Может окисляться:
- [math]\displaystyle{ \mathsf{NaAsO_2 + NaClO + 2NaOH \ \xrightarrow{}\ Na_3AsO_4 + NaCl + H_2O } }[/math]
- и восстанавливаться:
- [math]\displaystyle{ \mathsf{2NaAsO_2 + 3SnCl_2 + 14HCl \ \xrightarrow{}\ 2As\downarrow + 3H_2[SnCl_6] + 2NaCl + 4H_2O } }[/math]
- Вступает в обменные реакции:
- [math]\displaystyle{ \mathsf{NaAsO_2 + AgNO_3 \ \xrightarrow{}\ AgAsO_2\downarrow + NaNO_3 } }[/math]
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.