Лактатдегидрогеназа
| Лактатдегидрогеназа | |
|---|---|
| Идентификаторы | |
| Шифр КФ | 1.1.1.27 |
| Номер CAS | 9001-60-9 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9001-60-9 |
| Лактатдегидрогеназа A (субъединица M) | |
|---|---|
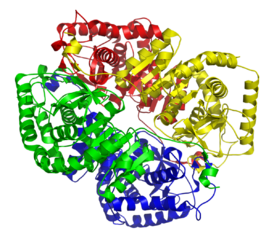 Лактатдегидрогеназа M4 (изофермент обнаруженный в скелетных мышцах). PDB 1I10. Лактатдегидрогеназа M4 (изофермент обнаруженный в скелетных мышцах). PDB 1I10. | |
| Обозначения | |
| Символы | LDHA; LDHM |
| Entrez Gene | 3939 |
| HGNC | 6535 |
| OMIM | 150000 |
| RefSeq | NM_005566 |
| UniProt | P00338 |
| Другие данные | |
| Шифр КФ | 1.1.1.27 |
| Локус | 11-я хр., 11p15.4 |
| Лактатдегидрогеназа B (субъединица H) | |
|---|---|
| Обозначения | |
| Символы | LDHB; LDHL |
| Entrez Gene | 3945 |
| HGNC | 6541 |
| OMIM | 150100 |
| RefSeq | NM_002300 |
| UniProt | P07195 |
| Другие данные | |
| Шифр КФ | 1.1.1.27 |
| Локус | 12-я хр., 12p12.2-12.1 |
| Лактатдегидрогеназа С субъединица | |
|---|---|
| Обозначения | |
| Символы | LDHC |
| Entrez Gene | 3948 |
| HGNC | 6544 |
| OMIM | 150150 |
| RefSeq | NM_002301 |
| UniProt | P07864 |
| Другие данные | |
| Шифр КФ | 1.1.1.27 |
| Локус | 11-я хр., 11p15.5-15.3 |
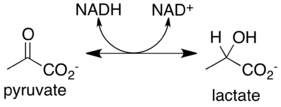
Лактатдегидрогеназа (L-лактат: NAD-оксидоредуктаза (LDH) 1.1.1.27) — фермент, принимающий участие в реакциях гликолиза[1]. Лактатдегидрогеназа катализирует превращение лактата в пируват, при этом образуется NADH.
Впервые лактатдегидрогеназа получена из отмытой мышцы Маергофом в 1909 году, а в 1940 году Штрауб получил её в кристаллическом виде.
Лактатдегидрогеназа устойчива к химическим воздействиям, например к действию реактивов, окисляющих или блокирующих сульфгидрильные группы, например йодоацетат и йодобензоат. Активность лактатдегидрогеназы снижается при повышении концентрации пирувата выше 10−4 М. Значительное инактивирование, обратимое при добавлении цистеина, происходит при инкубировании с парахлормеркурибензоатом.
Коферментом лактатдегидрогеназы является никотинамидадениндинуклеотид, сокращенно NAD. NAD — кофермент динуклеотидного типа, в котором два нуклеозид-5'-монофосфата соединены фосфоангидридной связью.
Анализ на ЛДГ входит в биохимический анализ крови. Нормы:
- новорожденные — до 2000 Ед/л
- дети до 2 лет — 430 Ед/л
- дети от 2 до 12 — 295 Ед/л
- дети старше 12 лет и взрослые — 250 Ед/л
Реакция
Лактатдегидрогеназа катализирует взаимопревращение пирувата и лактата с сопутствующим взаимопревращением NADH и NAD+. Он превращает пируват, конечный продукт гликолиза, в лактат, когда кислород отсутствует или его не хватает, и он выполняет обратную реакцию во время цикла Кори в печени. При высоких концентрациях лактата фермент проявляет ингибирование с обратной связью, и скорость превращения пирувата в лактат снижается. Она также катализирует дегидрирование 2-гидроксибутирата, но это гораздо более бедный субстрат, чем лактат.
Активный центр
ЛДГ у людей использует His(193) в качестве акцептора протонов и работает в унисон с коферментом (Arg 99 и Asn 138) и остатками, связывающими субстрат (Arg106; Arg169;Thr 248)[2][3]. Активный сайт His (193) обнаружен не только в человеческой форме ЛДГ, но и у многих разных животных, что свидетельствует о конвергентной эволюции ЛДГ. Две разные субъединицы ЛДГ (ЛДГ-A, также известная как М-субъединица ЛДГ, и ЛДГ-B, также известная как Н-субъединица ЛДГ) сохраняют один и тот же активный сайт и одни и те же аминокислоты, участвующие в реакции. Заметным различием между двумя субъединицами, составляющими третичную структуру ЛДГ, является замена аланина (в М-цепи) на глютамин (в Н-цепи). Считается, что это крошечное, но заметное изменение является причиной того, что Н-субъединица может быстрее связывать NAD, а каталитическая активность М-субъединицы не снижается в присутствии ацетилпиридиндениндинуклеотида, тогда как активность Н-субъединицы снижается в пять раз[4].
Изоферменты лактатдегидрогеназы
Имеют разный состав субъединиц М (muscle) и Н (heart). Нумерация идет в зависимости от подвижности в геле при электрофорезе[5].
ЛДГ 1 — (НННН) — обладающий наибольшей подвижностью, содержится преимущественно в миокарде;
ЛДГ 2 — (НННМ) — преимущественно локализован в эритроцитах и почках.
ЛДГ 3 — (ННММ) — преимущественно содержится в легких;
ЛДГ 4 — (НМММ) — преимущественно локализован в скелетных мышцах и отчасти в гепатоцитах. Это причина того, что при болезни Боткина, в сыворотке крови больного одновременно повышается активность и содержание ЛДГ-5 и ЛДГ-4;
ЛДГ 5 — (ММММ) — обладающий наименьшей подвижностью, преимущественно локализован в гепатоцитах;
Изоферменты используются при диагностике инфарктов, ишемий, повреждения почек и т. д. Уровень лактатдегидрогеназы коррелирует со степенью тяжести заболевания, спровоцировавшего выброс фермента в кровь[6].
Примечания
- ↑ В.П. Комов, В.Н. Шведова. Биохимия. — 2008.
- ↑ Roger S. Holmes, Erwin Goldberg. Computational analyses of mammalian lactate dehydrogenases: Human, mouse, opossum and platypus LDHs (англ.) // Computational Biology and Chemistry. — 2009-10. — Vol. 33, iss. 5. — P. 379–385. — doi:10.1016/j.compbiolchem.2009.07.006.
- ↑ Helen M. Wilks, Keith W. Hart, Raymond Feeney, Cameron R. Dunn, Hilary Muirhead. A Specific, Highly Active Malate Dehydrogenase by Redesign of a Lactate Dehydrogenase Framework (англ.) // Science. — 1988-12-16. — Vol. 242, iss. 4885. — P. 1541–1544. — ISSN 1095-9203 0036-8075, 1095-9203. — doi:10.1126/science.3201242.
- ↑ W Eventoff, M G Rossmann, S S Taylor, H J Torff, H Meyer. Structural adaptations of lactate dehydrogenase isozymes. (англ.) // Proceedings of the National Academy of Sciences. — 1977-07. — Vol. 74, iss. 7. — P. 2677–2681. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.74.7.2677.
- ↑ Т.И. ПУШКАРЕВА, Е.Б. РОМАНЦОВА, В.В. ЯКОВУК. ПОКАЗАТЕЛИ КРОВИ У ДЕТЕЙ (ВОЗРАСТНЫЕ ОСОБЕННОСТИ). — Благовещенск, 2010.
- ↑ ЛДГ-1 изофермент (рус.) ?. dialab.ru. Дата обращения: 23 января 2021. Архивировано 29 января 2021 года.
В статье не хватает ссылок на источники (см. также рекомендации по поиску). |