Винная кислота
| Винная кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Традиционные названия | Винная кислота | ||
| Хим. формула | НООССН(ОН)СН(ОН)СООH | ||
| Физические свойства | |||
| Молярная масса | 150,1 г/моль | ||
| Плотность | |||
| Термические свойства | |||
| Температура | |||
| • плавления |
|
||
| Химические свойства | |||
| Константа диссоциации кислоты [math]\displaystyle{ pK_a }[/math] |
при 25 °C: D,L- pKa1 = 2,95, pKa2=4,25 мезо- pKa1 = 3,22 pKa2=4,85 |
||
| Растворимость | |||
| • в воде | 139,44 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS |
87-69-4 L-(+), |
||
| SMILES |
|
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
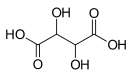
Ви́нная кислота́ (виннокаменная кислота, кислота, тартаровая кислота, 2,3-дигидроксибутандиовая кислота) [math]\ce{ HOOC-CH(OH)-CH(OH)-COOH }[/math] — двухосновная гидроксикислота. Соли и анионы винной кислоты называют тартратами.
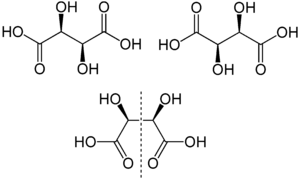
Изомерия
Известны три стереоизомерные формы винной кислоты: D-(−)-энантиомер (слева вверху), L-(+)-энантиомер (справа вверху) и мезо-форма (мезовинная кислота):
Рацемическая смесь энантиомерных винных кислот известна как виноградная кислота.
Получение
Винная кислота — распространённое природное соединение. В значительном количестве она содержится в кислом соке многих фруктов, например, в виноградном соке. D-винную кислоту получают действием минеральных кислот на её кислую калиевую соль (винный камень), образующуюся при брожении виноградного сока. При пиролизе D-винная кислота декарбоксилируется с образованием пировиноградной [math]\ce{ CH3(CO)COOH }[/math] и пировинной (метилянтарной) [math]\ce{ HOOCCH(CH3)CH2COOH }[/math] кислот. Она восстанавливается до янтарной кислоты, восстанавливает аммиачный раствор [math]\ce{ AgNO3 }[/math] до [math]\ce{ Ag }[/math]; в щелочной среде растворяет [math]\ce{ Cu(OH)2 }[/math] с образованием прозрачного ярко-синего раствора — реактива Фелинга.
Применение
Применяется в пищевой промышленности (пищевая добавка Е334), в медицине, в аналитической химии для обнаружения альдегидов, сахаров и др., в химической и фармакологической промышленности для разделения рацематов органических веществ на изомеры. Соли винной кислоты (тартраты) используются в медицине, при крашении тканей и др.
См. также
Примечания
- ↑ Перейти обратно: 1,0 1,1 1,2 K. Peter C. Vollhardt: Organische Chemie, VCH Weinheim, 1. korrigierter Nachdruck der 1. Auflage, 1990, S. 166, ISBN 3-527-26912-6.