Ван ден Брук, Антониус
| Антониус ван ден Брук | |
|---|---|
| Antonius Johannes van den Broek | |
 Ван ден Брук, около 1918 года Ван ден Брук, около 1918 года | |
| Дата рождения | 4 мая 1870 |
| Место рождения | Зутермер, Нидерланды |
| Дата смерти | 25 октября 1926 (56 лет) |
| Место смерти | Билтховен, Нидерланды |
| Страна | Нидерланды |
| Научная сфера | атомная и ядерная физика |
| Альма-матер |
Лейденский университет Парижский университет |
| Известен как | автор гипотезы о равенстве порядкового номера элемента заряду ядра, основоположник протонно-электронной модели строения атомных ядер |
Антониус Йоханнес ван ден Брук (нидерл. Antonius Johannes van den Broek; 4 мая 1870, Зутермер — 25 октября 1926, Билтховен[нидерл.]) — нидерландский юрист и физик-любитель. Несмотря на отсутствие специального образования, получил несколько результатов, оставивших след в истории науки. Ему принадлежит первая формулировка положения о равенстве порядкового номера элемента в периодической системе заряду атомного ядра. С именем ван ден Брука связано возникновение ранних теоретических представлений о составе ядра, в частности им была предложена протон-электронная модель ядерного строения. В своих работах он неоднократно пытался найти верный принцип расположения элементов в периодической системе и разработать метод вычисления всех возможных в природе изотопов.
Биография
Антониус ван ден Брук родился 4 мая 1870 года в деревне Зутермер близ Гааги в семье, происходившей с одного из прибрежных островов Северного моря. О ранних годах ван ден Брука и его родителях известно очень мало. Отец, Ян Адриан ван ден Брук (Jan Adriaan van den Broek, 1832 — ?), по-видимому, сначала работал деревенским нотариусом, а затем основал нотариальную контору в Гааге. Мать, Виллемина Франсина Нёй (Willemina Francina Nuij, 1830—1912), была образованной женщиной, интересовавшейся естественными науками, и, вероятно, передала этот интерес сыну. В сентябре 1889 года ван ден Брук поступил на юридическое отделение Лейденского университета, с ноября 1891 года в течение двух или трёх лет учился в Сорбонне, а затем вернулся в Лейден, где 22 октября 1895 года защитил диссертацию и получил степень доктора юриспруденции. В его диссертационной работе были затронуты некоторые вопросы совершенствования нидерландского уголовного и торгового кодексов[1].
После защиты и примерно до 1902 года ван ден Брук работал в конторе своего отца. В 1896 году он женился на Элизабет Маргарете Мауве (Elisabeth Margaretha Mauve, 1875—1948), дочери известного художника Антона Мауве. Уже в следующем году у них родился сын, а в дальнейшем — ещё три дочери. К этому времени относится недолгое увлечение супругов толстовством, они посещали собрания местного толстовского общества. В 1899 году ван ден Брук начал посещать лекции по праву в Амстердамском университете, а после 1902 года отправился за границу, чтобы изучать экономику: сначала в Вене (у профессора Карла Менгера), а затем в Берлине (у Адольфа Вагнера и Густава Шмоллера). Ван ден Брука, по-видимому, интересовали прежде всего философские и математические аспекты экономики, однако его занятия, судя по всему, ограничились общим знакомством с проблемами этой дисциплины и не принесли ему удовлетворения[2].

В декабре 1905 — феврале 1906 года ван ден Брук совершил путешествие по Румынии, Греции и Турции. Примерно в это время он начал систематически заниматься естественными науками. Сделать этот вывод позволило счастливое стечение обстоятельств. В конце 1960-х годов академик АН БССР Михаил Ельяшевич обнаружил в Фундаментальной библиотеке АН БССР в Минске несколько рукописных фрагментов, находившихся между страниц одного из выпусков журнала Philosophical Magazine за 1914 год. Изучение этих текстов позволило заключить, что они были написаны рукой ван ден Брука. В результате обследования фондов библиотеки, проведённого в 1978—1979 годах историком Юрием Лисневским, было установлено, что ряд номеров журнала Philosophical Magazine с января 1906 по январь 1924 года принадлежали голландскому учёному. Пометки на полях журнала свидетельствуют, что первый и часть второго номера за 1906 год были прочитаны полностью; пометки на других выпусках указывают на круг основных научных интересов ван ден Брука — радиоактивность, строение атома, рентгеновские лучи. Детальное описание находок — помет и вложений (рукописей, вырезок и так далее) — было проведено Лисневским и позволило значительно расширить представления о жизни и творчестве физика-любителя. Каким образом издания из личной библиотеки ван ден Брука оказались в Минске, до конца не ясно. По-видимому, после смерти учёного его вдова продала журналы, а те попали в Минск после Великой Отечественной войны, когда происходило восстановление разграбленных оккупантами фондов Фундаментальной библиотеки[3][4].
Как бы то ни было, с марта 1906 года ван ден Брук выписывал журнал Philosophical Magazine, а также, возможно, Nature и Physikalische Zeitschrift. Уже через год интенсивных занятий он написал свою первую научную работу, которая была опубликована в немецком журнале Annalen der Physik. До сих пор остаются неясными причины неожиданного обращения ван ден Брука к естественнонаучной тематике. Согласно предположению Лисневского, основанному на сведениях, полученных от родственников учёного, интерес ван ден Брука к физике проявился достаточно рано под влиянием матери; это подтверждают глубокие познания, которые он проявил уже при написании первой своей статьи и которые едва ли можно было приобрести всего за один год. Однако склонность к научным изысканиям долгое время оставалась нереализованной: на выбор профессии решающее влияние оказала воля отца. Вероятно, около 1900 года отец скончался, и ван ден Брук, почувствовав себя свободным от прежних обязательств, приступил к «поискам себя». Отсюда его временное увлечение экономикой; на смену ему пришли систематические занятия физикой, которым он не изменял до конца жизни[5].

Несмотря на новые интересы, ван ден Брук по-прежнему выполнял обязанности юриста, связанные в основном с продажей и покупкой земли, строительством и подобными вопросами. В 1903—1911 годах он жил с семьёй в Бур-ла-Рен под Парижем и в Гаутинге под Мюнхеном, в последующие годы — в разных городках Нидерландов (Нордвейк, Горссель, Де-Бильт, Схевенинген), периодически выезжая за границу: любил бывать в Париже, посещал Италию и дважды Испанию. Со студенческих лет он увлекался архитектурой и строительством и в 1920 году построил дом шестиугольной формы, которую считал более рациональной, чем обычные четырёхугольные здания; с друзьями ван ден Брук основал кооперативный посёлок Билтховен (нидерл. Bilthoven) под Утрехтом. В сферу его интересов входила и музыка, он хорошо играл на фортепиано. Как писала много лет спустя дочь ван ден Брука, своё увлечение наукой он старался не афишировать: «Он никогда не сообщал о своих занятиях и публикациях. Я не считаю, что он был несчастлив в семье, однако был очень замкнут. Его общественные контакты большей частью ограничивались друзьями по работе. Он всегда был вежливым и добрым в общении. Его здоровье всегда было очень плохим… Я никогда не могла понять, что он делал в течение многих часов, неподвижно уставившись в одну точку. Это раздражало меня. Теперь я могу понять, что он работал — без стола, без бумаг, без карандаша. Только маленький блокнот для заметок и то не всегда»[6].
Всего ван ден Брук опубликовал 23 статьи, посвящённые периодической системе элементов, строению атома и явлению изотопии. В них в полной мере проявилось особое умение автора находить количественные соотношения в больших массивах внешне несвязанных данных. По словам известного физика Хендрика Крамерса, «мистерия чисел… была для его одарённой натуры особенно привлекательной». Работы ван ден Брука отличались смелостью идей и гипотез, которые порой кажутся недостаточно согласованными и поверхностными. Учёный, однако, всегда пытался дать высказываемым положениям физическое обоснование, связать их с самыми последними экспериментальными данными. Вместе с тем отсутствие профессиональной подготовки сказывалось на стиле его работ: нарушения логики изложения материала, неудачная структура статей, нечёткость и неоднозначность формулировок затрудняли понимание мысли автора[7].
По-видимому, у ван ден Брука не было никаких контактов с профессиональными учёными до 1923 года, когда профессора Эрнст Коэн (англ. Ernst Cohen) из Утрехта и Реммельт Сиссинг (Remmelt Sissingh) из Амстердама рекомендовали принять его в Голландское королевское общество наук (нидерл. Koninklijke Hollandsche Maatschappij der Wetenschappen) в Харлеме. На очередном заседании общества знаменитый Хендрик Лоренц выступил с характеристикой работ ван ден Брука, после чего последний был избран членом этой организации. С этого времени между двумя учёными установилась связь, велась научная переписка. Слабое здоровье ван ден Брука ещё сильнее пошатнулось из-за пережитой личной трагедии: зимой 1917 года погиб его 19-летний сын, провалившись под лёд во время катания на коньках на Зёйдерзе. В конце 1924 года учёный тяжело заболел, у него была обнаружена анемия в запущенной форме. 25 октября 1926 года он скончался в Билтховене, где и был похоронен. Последняя рукопись ван ден Брука была передана его вдовой Лоренцу, однако из-за скорой смерти последнего была опубликована лишь в 1929 году с предисловием Крамерса[8].
Научное творчество
Первые работы о периодической системе
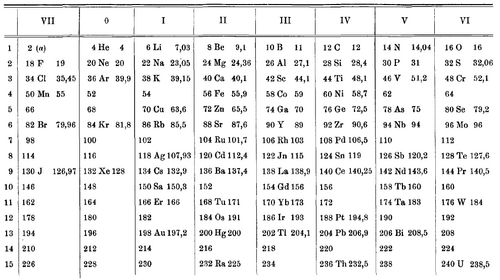
Остаются неизвестными причины интереса ван ден Брука к структуре периодической системы элементов. Этот интерес не ограничивался проблемой размещения некоторых элементов в таблице Менделеева, а захватывал и более глубокие вопросы о строении атома. В своей первой работе «Альфа-частица и периодическая система элементов» (нем. Das α-Teilchen und das periodische System der Elemente, 1907) ван ден Брук сформулировал так называемую альфадную гипотезу о структуре периодической системы. Исходным пунктом стали результаты Эрнеста Резерфорда, который в 1906 году измерил отношение заряда к массе альфа-частицы и высказал в этой связи предположение, что альфа-частица может представлять собой целый атом гелия или его половину. Именно половину атома гелия, имеющую заряд 1 и массу 2 (в единицах заряда и массы иона водорода, то есть протона) и названную им «альфоном», ван ден Брук положил в основу построения системы элементов. Увеличивая количество этих структурных единиц, учёный составил таблицу атомных весов и сопоставил её с системой Менделеева. Полученная идеализированная таблица давала общую картину возрастания атомных весов, однако детали описать не могла. Так, атомные веса элементов, известные к тому времени с хорошей точностью, отнюдь не были чётными числами (пропорционально массе альфона), как это получалось у ван ден Брука. Хотя аргументация автора была неубедительной, альфадная гипотеза содержала в неявном виде следующую важную идею: поскольку номер элемента в таблице определялся числом альфонов, а заряд альфона равен 1, то, следовательно, номер элемента равен числу входящих в него элементарных зарядов. Эту мысль ван ден Брук в полной мере осознал лишь много времени спустя[9][10].

Вторая работа ван ден Брука, «Менделеевская „кубическая“ периодическая система элементов и расположение радиоэлементов в этой системе» (нем. Das Mendelejeffsche «kubische» periodische System der Elemente und die Einordnung der Radioelemente in dieses System, опубликована 15 июня 1911 года), продолжала линию, начатую в его первой статье. Он попытался реализовать идею, вскользь упомянутую Менделеевым ещё в 1869 году, и расположил элементы не в виде плоской таблицы, а в виде параллелепипеда («куба») из восьми мест в ширину, пяти в высоту и трёх в глубину. На этот раз в систему были включены редкоземельные и новые радиоактивные элементы (правда, только испускающие альфа-лучи). Хотя понятие альфона уже не использовалось, математическая основа таблицы была, по существу, той же: вводился «теоретический атомный вес», который принимал чётные значения от 4 до 242. Это отражало взгляды ван ден Брука на понятие периодичности, которое, согласно его определению, соответствует постоянству разности атомных весов соседних элементов. Поскольку в менделеевской системе эти разности постепенно растут (а не остаются равными 2), он искал способ улучшить её и приблизить расположение элементов к своему теоретическому идеалу. Здесь же им впервые была построена зависимость атомных весов от порядковых номеров элементов в периодической таблице, которая, по его мысли, свидетельствовала о преимуществе «кубической» системы. Таким образом, появилась идея порядкового номера, которая в дальнейшем сыграла важную роль в развитии взглядов учёного[11][12].
Порядковый номер и заряд ядра
В мае 1911 года была опубликована знаменитая статья Резерфорда, в которой была сформулирована новая (ядерная) модель атома. Согласно оценкам, полученным независимо Резерфордом и Баркла, заряд центрального массивного тела («ядра») приблизительно равен половине атомного веса ([math]\displaystyle{ Z \approx A/2 }[/math]). Уже 20 июля 1911 года в журнале Nature появился отклик ван ден Брука на работу Резерфорда — заметка «Количество возможных элементов и „кубическая“ периодическая система Менделеева» (англ. The number of possible elements and Mendeléeff's «cubic» periodic system). Поскольку разность атомных весов соседних элементов в «кубической» системе равна в среднем 2, а количество зарядов каждого знака равно половине атомного веса, то соседние элементы должны отличаться по заряду на единицу. Следовательно, «количество возможных элементов равно количеству возможных постоянных зарядов каждого знака в атоме, или каждому возможному постоянному заряду (обоих знаков) в атоме соответствует возможный элемент». Эта гипотеза прямо выводила ван ден Брука на идею о заряде как основной характеристике химического элемента и об идентичности заряда и порядкового номера. Эта мысль, однако, ещё не была высказана в явном виде, а заметка осталась незамеченной научным сообществом. Причиной, вероятно, была увязка высказанной гипотезы с «кубической» системой элементов, неудовлетворительность которой вскоре стала ясна и самому ван ден Бруку[13][14]. «Таким образом, — писал известный физик и историк науки Абрахам Пайс, — основываясь на неправильной версии периодической таблицы и на неправильном соотношении между [math]\displaystyle{ Z }[/math] и [math]\displaystyle{ A }[/math], в физику впервые вошло главенство [math]\displaystyle{ Z }[/math] как порядкового номера периодической системы»[15].
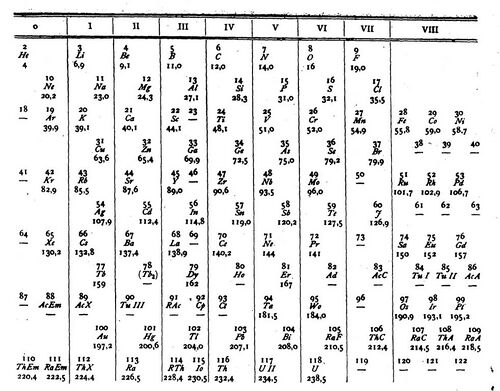
1 января 1913 года была опубликована, пожалуй, самая важная в творчестве ван ден Брука работа — статья «Радиоэлементы, периодическая система и строение атома» (нем. Die Radioelemente, das periodische System und die Konstitution der Atome). Она состоит из двух слабо связанных частей. В первой предлагалась очередная версия периодической системы, значительно приближенная к традиционной менделеевской. В некоторые клетки системы, названной автором «расширенной», включались по два или три элемента. Из радиоэлементов включались только альфа-излучатели: считалось, что поскольку бета-радиоактивность не изменяет массы атома, элемент остаётся тем же. В качестве «теоретических атомных весов» на этот раз использовались предложенные Теодором Вульфом (англ. Theodor Wulf) числа [math]\displaystyle{ 4n }[/math] и [math]\displaystyle{ 4n+3 }[/math], и было проведено их сравнение с экспериментальными данными. Несовпадение этих величин, по словам ван ден Брука, не следует принимать слишком всерьёз, поскольку, возможно, не масса, а внутриатомный заряд является ключевой характеристикой атомной структуры. Детальному исследованию роли заряда посвящена вторая часть статьи. Проанализировав данные экспериментов по бета-радиоактивности, анодным лучам (англ. Anode ray) и характеристическому рентгеновскому излучению, свидетельствовавших о наличии в атомах нескольких групп электронов, ван ден Брук ввёл понятие порядкового номера (нем. Folgenummer) элемента в периодической системе и сформулировал следующую гипотезу: «Порядковый номер каждого элемента в ряду, расположенном по повышающимся атомным весам, равен половине атомного веса и равен внутриатомному заряду». Учёный связал эту гипотезу с известными из опытов сведениями и дал в принципе верную картину атомного строения: периоды таблицы Менделеева соответствуют формированию связанных групп электронов, заполняющих некоторые области внутри атомов. Хотя понятие порядкового номера вводилось ранее в не известных ван ден Бруку работах Джона Ньюлендса и Йоханнеса Ридберга, у голландского физика оно впервые получило физическое содержание — заряд ядра в резерфордовской модели атома. Несмотря на то, что предложенная гипотеза появилась в контексте «расширенной» системы элементов, она не противоречила и данным менделеевской системы, а потому привлекла внимание научного сообщества. Прежде всего, на неё обратил внимание Нильс Бор, который, вероятно, обсуждал её с Резерфордом и прямо сослался на результаты ван ден Брука в своей работе, посвящённой теории атомного строения и опубликованной в сентябре 1913 года[16][17].
Что касается «расширенной» системы элементов, то после появления в начале 1913 года правил радиоактивных смещений, сформулированных Казимиром Фаянсом и Фредериком Содди, её следовало признать неверной. К осени ван ден Брук отказался от неё, вернулся к стандартной системе Менделеева и вместе с тем подверг сомнению экспериментальное соотношение [math]\displaystyle{ Z \approx A/2 }[/math], отделив его от своей гипотезы. В статье «Внутриатомный заряд» (англ. Intra-atomic charge), опубликованной в журнале Nature 27 ноября 1913 года, эта гипотеза получила следующую формулировку: «Если все элементы расположить в порядке возрастания атомных весов, номер каждого элемента в таком ряду должен быть равен его внутриатомному заряду». Подтверждение своей точки зрения он нашёл в данных опытов Ганса Гейгера и Эрнеста Марсдена по рассеянию альфа-частиц на атомах различных элементов[18][19]. Отказ от соотношения [math]\displaystyle{ Z \approx A/2 }[/math] не только позволял более точно определить внутриатомный заряд, но также требовал пересмотра представлений о строении атомного ядра: если, как тогда считалось, оно состоит из набора альфа-частиц, то для компенсации лишнего положительного заряда приходилось предположить наличие внутри ядра некоторого количества электронов. Всё это находилось в согласии с гипотезой ван ден Брука, как он показал в своей работе «О ядерных электронах» (англ. On nuclear electrons, март 1914)[20].
Уже в декабре 1913 года на страницах журнала появились заметки Содди и Резерфорда, которые решительно поддержали выводы ван ден Брука. При этом первый из них ввёл новый термин «изотопы» для элементов, занимающих одинаковое место в периодической системе, а также показал, что явление изотопии и эмпирические правила радиоактивных смещений получают естественное объяснение в контексте гипотезы ван ден Брука. В работе же Резерфорда впервые появилось понятие «атомный номер» (англ. atomic number) для характеристики положения элемента в таблице Менделеева. Убедительным свидетельством в пользу гипотезы о порядковых номерах стали классические эксперименты Генри Мозли по определению частот характеристического рентгеновского излучения. Эти опыты, первые результаты которых были представлены в декабре 1913 года, проводились под непосредственным влиянием работ ван ден Брука и при поддержке Резерфорда[21]. В статье «Ординалы или атомные числа?» (англ. Ordinals or atomic numbers?, октябрь 1914) ван ден Брук показал, что «ординалы», порядковые числа, предложенные Ридбергом и превышающие на две единицы атомные номера Мозли, не дают такого хорошего объяснения экспериментальным данным, как последние. Многочисленные проверки, проведённые в последующие годы различными методами, свидетельствовали, что заряд ядра действительно увеличивается на единицу от элемента к элементу в полном соответствии с гипотезой ван ден Брука[22].
Следует отметить, что открытие атомного номера часто приписывается Бору или Мозли, хотя они никогда не претендовали на приоритет и в своих работах того времени всегда ссылались на ван ден Брука. Недооценка вклада голландского физика-любителя, вероятно, проистекает из недостатка сведений о его жизни и творчестве, большой «плотности» событий в науке в районе 1913 года, что зачастую затрудняло разделение результатов разных учёных; сыграл свою роль и трагический ореол, окружающий фигуру Мозли[23]. Как писал Эрик Серри (англ. Eric Scerri), специалист по истории периодической системы:
Открытие атомного номера даёт повод для небольшого отступления о том, как история науки зачастую переписывается и вычищается последующими комментаторами. Настоящим первооткрывателем был учёный-любитель Антон ван ден Брук, чьим вкладом обычно пренебрегают. Часто думают, что ван ден Брук лишь подвёл итог работы физиков Резерфорда и Баркла, но подлинная история совершенно иная.
Оригинальный текст (англ.)— Scerri E. R. The Periodic Table: Its Story and Its Significance. — Oxford University Press, 2007. — P. 165.
Строение атомного ядра

Выдвинув ядерную модель атома, Резерфорд в работах 1911—1912 годов фактически не затронул проблему строения ядра, ограничившись упоминанием альфа-частиц как возможного его компонента. Ван ден Брук в своей статье от 1 января 1913 года впервые высказал конкретные соображения о составе центрального тела атома. Исходя из общих соображений, он предположил, что помимо альфа-частиц, комбинации которых явно недостаточно для объяснения наблюдаемых атомных весов, ядро может включать ион легчайшего атома — водорода (то есть протон), а также дополнительные электроны для компенсации избыточного положительного заряда. В таком случае сама альфа-частица (ядро гелия) должна состоять из четырёх ионов водорода и двух электронов. Более того, для объяснения отклонения атомных весов от целых чисел ван ден Брук предположил, что в ядро могут входить и другие, ещё не открытые компоненты с единичным положительным зарядом, но массой меньшей, чем у протона. В этой же статье содержался и другой важный вывод: поскольку размер ядра, как показал Резерфорд, очень мал по сравнению с размером всего атома, то структура центрального тела не должна оказывать влияния на свойства атома; важен лишь итоговый заряд ядра. Этот вывод вскоре был поддержан Бором и использован им при создании теории атомного строения[24].
В упоминавшейся работе «Внутриатомный заряд» ван ден Брук на основе своей гипотезы привёл аргументы в пользу того, что заряд ядра должен быть меньше половины атомного веса, то есть [math]\displaystyle{ Z \lt A/2 }[/math]. Это свидетельствовало о том, что помимо альфа-частиц ядро должно содержать электроны (бета-частицы) для компенсации излишнего положительного заряда. Предполагалось, что эти электроны ответственны за бета-радиоактивность. В статье «О ядерных электронах» учёный высказал соображения об ионе водорода как компоненте ядра; впервые он показал, что если считать атомный вес целым числом, центральное тело атома можно представить состоящим из [math]\displaystyle{ A }[/math] ионов водорода и [math]\displaystyle{ A-Z }[/math] ядерных (компенсирующих) электронов. Эта гипотеза, чётко сформулированная ван ден Бруком, означала рождение протон-электронной модели ядра, которая в дальнейшем развивалась Резерфордом и другими исследователями и оставалась общепринятой на протяжении почти двадцати лет, до открытия нейтрона[25].
На протяжении нескольких следующих лет ван ден Брук пытался использовать полученные им результаты для углубления представлений о строении атома и высказал в этой связи несколько идей, которые в итоге не были приняты в физике. В частности, им была построена так называемая «сжатая» периодическая система с улучшенным расположением элементов, сформулированы представления о «внутризарядовых числах» и о возможном расположении электронов в кольцах вокруг ядра. В предложенной им в 1915 году модели атома предполагалось, что помимо положительного ядра в атоме присутствуют нейтральные частицы гелия, которые не вносят вклад в общий заряд ядра и которые ответственны за альфа-распад. Вероятно, это было первое упоминание нейтральных частиц в ядре, однако влияние этой гипотезы на развитие представлений о нейтроне не установлено[26].
Изотопия
Последние работы ван ден Брука были посвящены проблеме изотопии. Учёный поставил себе цель — теоретически определить стабильные изотопы всех химических элементов. Использованный им в мае 1916 года метод сводился к перенесению схемы распада радиоактивных рядов на всю периодическую систему. Такая [math]\displaystyle{ 4\alpha/2\beta }[/math]-схема (испускание четырёх альфа- и двух бета-частиц) позволила ему получить атомные веса изотопов всех элементов, многие из которых, однако, впоследствии оказались лишними; другие реальные изотопы были пропущены. В последующем учёный пытался детализировать и уточнить свою схему, чтобы построить «всеобщую систему изотопов», однако в целом метод расчёта оставался сложным и искусственным и не позволял правильно предсказать все известные сегодня изотопы. Как считается в настоящее время, существующие в природе изотопы не удаётся описать одной или несколькими распадными схемами[27].
Список опубликованных работ ван ден Брука
Известны 23 научные публикации Антониуса ван ден Брука, все написаны без соавторов:
- Das α-Teilchen und das periodische System der Elemente // Annalen der Physik. — 1907. — Bd. 328 (23). — S. 199—203. — doi:10.1002/andp.19073280614.
- Das Mendelejeffsche «kubische» periodische System der Elemente und die Einordnung der Radioelemente in dieses System // Physikalische Zeitschrift. — 1911. — Bd. 12. — S. 490—497.
- The number of possible elements and Mendeléeff's «cubic» periodic system // Nature. — 1911. — Vol. 87. — P. 78. — doi:10.1038/087078b0.
- Die Radioelemente, das periodische System und die Konstitution der Atome // Physikalische Zeitschrift. — 1913. — Bd. 14. — S. 32—41.
- A quantitative relation between the range of the α-particles and the number of charges emitted during disintegration // Philosophical Magazine. — 1913. — Vol. 25. — P. 740—742. — doi:10.1080/14786440508637391.
- Intra-atomic charge // Nature. — 1913. — Vol. 92. — P. 372—373. — doi:10.1038/092372c0.
- Intra-atomic charge and the structure of the atom // Nature. — 1913. — Vol. 92. — P. 476—478. — doi:10.1038/092476b0.
- On nuclear electrons // Philosophical Magazine. — 1914. — Vol. 27. — P. 455—467. — doi:10.1080/14786440308635109.
- Atomic models and regions of intra-atomic electrons // Nature. — 1914. — Vol. 93. — P. 7—8. — doi:10.1038/093007a0.
- The structure of atoms and molecules // Nature. — 1914. — Vol. 93. — P. 241—242. — doi:10.1038/093241b0.
- β- and γ-rays and the structure of the atom (internal-charge numbers) // Nature. — 1914. — Vol. 93. — P. 376—377. — doi:10.1038/093376b0.
- Zu dem «Nachtrag zu dem Aufsatz von Dr. K. Fajans: Die Radioelemente und das periodische System» // Naturwissenschaften. — 1914. — Bd. 2. — S. 717. — doi:10.1007/BF01497232.
- Radio-activity and atomic numbers // Nature. — 1914. — Vol. 93. — P. 480. — doi:10.1038/093480a0.
- Ordinals or atomic numbers? // Philosophical Magazine. — 1914. — Vol. 28. — P. 630—632. — doi:10.1080/14786441008635243.
- Röntgenstrahlung und Ordnungszahlen // Physikalische Zeitschrift. — 1914. — Bd. 15. — S. 894—895.
- Atombau und Atomzerfall // Arbeiten aus den Gebieten der Physik, Mathematik, Chemie: Festschrift Julius Elster und Hans Geitel zum 60. — Braunschweig: F. Vieweg und Sohn, 1915. — S. 428—434.
- A relation between atomic weights and radio-active constants // Nature. — 1916. — Vol. 96. — P. 677. — doi:10.1038/096677a0.
- Über die Isotopen sämtlicher chemischen Elemente // Physikalische Zeitschrift. — 1916. — Bd. 17. — S. 260—262.
- Is proto-oxygen the principal constituent of the atoms? // Nature. — 1916. — Vol. 97. — P. 479. — doi:10.1038/097479b0.
- Eine allgemeine Zwillingsreihe der Atomarten // Physikalische Zeitschrift. — 1916. — Bd. 17. — S. 579—581.
- Zur allgemeinen Isotopie // Physikalische Zeitschrift. — 1920. — Bd. 21. — S. 337—340.
- Das allgemeine System der Isotopen // Physikalische Zeitschrift. — 1921. — Bd. 22. — S. 164—170.
- Zum Problem der Isotopie // Archives Néerlandaises des Sciences Exactes et Naturelles, ser. 3A. — 1929. — Bd. 12. — S. 143—146.
Примечания
- ↑ Лисневский (книга), 1981, с. 15—16.
- ↑ Лисневский (книга), 1981, с. 17—19.
- ↑ Лисневский (книга), 1981, с. 20, 34—44.
- ↑ Лисневский (ВИЕТ), 1984.
- ↑ Лисневский (книга), 1981, с. 20—21.
- ↑ Лисневский (книга), 1981, с. 20, 22—24.
- ↑ Лисневский (книга), 1981, с. 25, 28, 144—146.
- ↑ Лисневский (книга), 1981, с. 24—29.
- ↑ Лисневский (книга), 1981, с. 60—64.
- ↑ Scerri, 2007, pp. 165—166.
- ↑ Лисневский (книга), 1981, с. 65—70.
- ↑ Scerri, 2007, p. 166.
- ↑ Лисневский (книга), 1981, с. 71—74.
- ↑ Scerri, 2007, p. 167.
- ↑ Pais A. Inward Bound: Of Matter and Forces in the Physical World. — Oxford University Press, 1986. — P. 227.
- ↑ Лисневский (книга), 1981, с. 76—87.
- ↑ Scerri, 2007, p. 168.
- ↑ Лисневский (книга), 1981, с. 88—93.
- ↑ Scerri, 2007, pp. 168—169.
- ↑ Лисневский (книга), 1981, с. 94—95.
- ↑ Лисневский (книга), 1981, с. 96—101, 105—106.
- ↑ Лисневский (книга), 1981, с. 108—110.
- ↑ Лисневский (книга), 1981, с. 111—121.
- ↑ Лисневский (книга), 1981, с. 122—125.
- ↑ Лисневский (книга), 1981, с. 126—133.
- ↑ Лисневский (книга), 1981, с. 134—137.
- ↑ Лисневский (книга), 1981, с. 137—143.
Литература
- Лисневский Ю. И. Антониус Ван-ден-Брук. — М.: Наука, 1981.
- Scerri E. R. The Periodic Table: Its Story and Its Significance. — Oxford University Press, 2007.
- Лисневский Ю. И. Ван ден Брук и его открытие // Природа. — 1977. — Вып. 1. — С. 106—113.
- Лисневский Ю. И. Новые материалы о жизни и творчестве А. Ван-ден-Брука // Вопросы истории естествознания и техники. — 1984. — Вып. 1. — С. 107—113.
- Лисневский Ю. И. Антониус Ван-ден-Брук. Дилетант, который не был дилетантом // Химия и жизнь. — 1985. — Вып. 11, 12. — С. 90—93, 76—79. Архивировано 19 декабря 2013 года.
- Храмов Ю. А. Ван ден Брук Антониус // Физики : Биографический справочник / Под ред. А. И. Ахиезера. — Изд. 2-е, испр. и доп. — М. : Наука, 1983. — С. 55. — 400 с. — 200 000 экз.
- Snelders H. A. M. Broek, Antonius Johannes van den // Biografisch Woordenboek van Nederland. — 1979. — Vol. 1.