Bicoid (ген)
Bicoid (от лат. bi+coid — два + хвост) — гомеозисный ген (обозначается bicoid или bcd) и белок дрозофилы, морфоген, определяющий развитие передней части тела (акрона, головы и торакса) эмбриона дрозофилы. мРНК этого белка образуется в ходе развития ооцита, поэтому ген bicoid относится к генам материнского эффекта. Белок является транскрипционным фактором и содержит гомеодомен; по некоторым данным, Bicoid является видоизменненым Hox-геном третьей группы [1].

За исследование генов эмбрионального развития, в числе которых был и Bicoid, в 1995 году Эрику Вишаусу и Кристиане Нюсляйн-Фольхард была присуждена Нобелевская премия по физиологии и медицине.
История исследования
Классические эксперименты показали, что в яйце насекомого существует по крайней мере два «организационных центра», один в передней части яйца и один в задней. Например, Клаус Сандер в 1975 году обнаружил, что если он перетягивал нитью (лигировал) яйца на ранних стадиях развития, отделяя переднюю область от задней, одна половина эмбриона развилась в переднюю, а другая превратилась в заднюю часть эмбриона, но ни одна половина не содержала средних сегментов эмбриона. Таким образом, оказалось, что существуют градиенты, исходящие из двух полюсов, и что эти градиенты взаимодействовали для получения позиционной информации для определения идентичности каждого сегмента. Кроме того, когда РНК из передней части яйца насекомых была разрушена (ультрафиолетовым светом или РНКазой), в результате у эмбрионов не хватало головы и груди(торакса). Вместо этого, у этих эмбрионов развивалось два брюшка и тельсона («хвосты»). Таким образом, Сандер постулировал существование градиента на обоих концах яйца, и предположил, что в яйце заключена РНК, которая генерирует градиент чего-то, ответственного за развитие переднего сегмента. В конце 1980-х градиентная гипотеза Клауса была объединена с генетическими исследованиями эмбриогенеза дрозофилы в ходе проекта Heidelberg screens, выявлявшего гены, влияющие на эмбриональное развитие. Кристиана Нюсляйн-Фольхард с коллегами открыла, что существует не менее трех наборов морфогенов: для переднего, заднего частей и терминальных областей эмбриона. За это открытие в 1995 году ей и Эрику Вишаусу была присуждена Нобелевская премия. Группа Эрика Вишауса в Принстонском университете до сих пор исследует механизм работы Bicoid, точнее, образование и исчезновение его градиента. Bicoid является одним из самых изученных морфогенов.
Молекулярный механизм действия
Создание градиента
мРНК bicoid синтезируется трофоцитами (nursing cells) во время созревания ооцита. В 3'-области мРНК bicoid находится сигнальный сайт, узнаваемый факторами локализации, белками Exuperantia (Exu) и Staufen (Stau). Они активны на средней и поздней стадии оогенеза соответственно. Эти белки помогают bicoid прикрепиться к динеину, который по микротрубочкам переносит мРНЕ bicoid в ближайшую к трофоцитам зону яйца. Локализация bicoid нарушается также при мутации белка Swallow, который напрямую с bicoid не связывается, но участвует в реорганизации микротрубочек и актинового цитоскелета на переднем конце ооцита.[2]. В ооцитах дрозофилы мРНК bicoid, также как и других генов материнского эффекта, например, nanos, не транслируется. Сохранение bicoid в виде мРНК объясняется коротким поли-(А) хвостом на 3'-конце транскрипта. В ооцитах мРНК, имеющие короткий поли-(А) хвост, не подвержены деградации, однако такие мРНК не транслируются. При оплодотворении белки Cortex и Grauzone удлиняют поли-(А) хвост, и запускается трансляция Bicoid.[3] В данный момент существуют споры относительно того, что именно создает градиент: мРНК, сам белок или оба вещества. Защитники гипотезы активного транспорта утверждают, что скорость диффузии белка недостаточна для создания градиента, и что, вероятно, происходит активный транспорт мРНК по филаментам, аналогичный транспорту в ооцит, а градиент белка повторяет градиент мРНК[4]. Теория группы Вишауса неизменна с конца 1980-х годов и использует модель синтез-диффузия-деградация (SDD), которая утверждает, что белок распространяется из полюса, где к концу оогенеза депонирована мРНК, а расстояние и время распространения белка определяется скоростью его синтеза, диффузии и деградации.[5]
Запускаемые процессы
Bicoid стимулирует развитие переднего отдела эмбриона дрозофилы двумя путями. С одной стороны, он связывается с мРНК caudal, ингибируя её трансляцию и таким образом подавляя программу развития заднего отдела, которую активирует caudal. [7] С другой стороны, он является транскрипционным фактором семейства Hox[8] и связывается с регуляторными участками гена hunchback, активируя его[9]. Для активации этого гена не нужны большие концентрации Bicoid, что также подтверждалось в экспериментах с нокаутом swallow и exuperantia: в таких мутантах нормально образовывались структуры торакса, но не головы. Было предсказано, что эти гены имеют энхансеры с меньшей аффинностью, что потом блестяще подтвердилось в эксперименте для генов buttonhead, empty spiracles и orthodenticle. Энхансеры этих генов также имеют сайт связывания Hunchback.[10] Под регуляцией Bicoid также находится ген knirps, который экспрессируется из всей передней части зародыша только в акроне, поскольку одновременно его репрессирует hunchback. На этом примере видно, что именно разные пространственно-временные комбинации имеют решающее значение для тонких эффектов смены программы для отдельных клеток. Аналогично, ген evenskipped активируется Bicoid только во втором брюшном сегменте, так как там наблюдается требуемая низкая концентрация Bicoid, а также присутствует Hunchback.[11]

Эксперименты, подтверждающие механизм действия
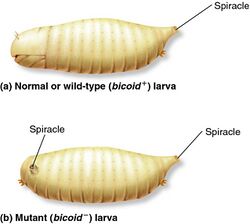
В яйцах гомозиготных мутантных самок bcd-/- белок Bicoid отсутствует. Зародыши, которые развиваются из таких яиц, не имеют передних сегментированных отделов. Если в переднюю область яйца, взятого от самки bcd-/-, трансплантировать цитоплазму переднего конца яйца от самки дикого типа, то нормальное развитие восстанавливается. Введение цитоплазмы яйца, содержащей продукты гена bcd? в среднюю область яиц bcd-/- формирует двусторонний градиент белка Bicoid, направленный из центральной области яйца к переднему и заднему концам. Соответственно, развивается уродливая личинка с передними структурами в центральной области и с задними структурами на полюсах яйца.[12]
Эволюция и консервативность
Несмотря на свою ключевую роль в регуляции развития передних сегментов плодовой мушки, белок Bicoid имеет короткую эволюционную историю. Поиск консервативности последовательности указывает, что ген bcd был приобретен двукрылыми недавно, в результате дупликации гомолога Hox3 под названием zerknullt. Другие же морфогены, такие как Hunchback и Caudal, чрезвычайно консервативны. Учитывая транскрипционную синергию между материнскими Hb и Bcd, была предложена теория, что предки двукрылых имели только Hunchback, а всю регуляцию, связанную с Bicoid, приобрели позднее. Однако последние исследования построения передне-задней оси у родственных видов, не имеющих гомологов Bicoid, но имеющих Hunchback, показывают наличие белка Orthodenticle (Otd), имеющего гомеодомен с такой же специфичностью, как и у Bicoid. Такими организмами являются жук Tribolium и оса Nasonia.[13]
См. также
Примечания
- ↑ Shawn C. Little, Gašper Tkačik, Thomas B. Kneeland, Eric F. Wieschaus, Thomas Gregor. The Formation of the Bicoid Morphogen Gradient Requires Protein Movement from Anteriorly Localized mRNA // PLoS Biol. — 2011. — Т. 9, № 3. — doi:10.1371/journal.pbio.1000596. Архивировано 20 апреля 2013 года.
- ↑ Timothy T. Weil, Despina Xanthakis, Richard Parton, Ian Dobbie, Catherine Rabouille, Elizabeth R. Gavis, and Ilan Davis. Distinguishing direct from indirect roles for bicoid mRNA localization factors // Development. — 2010. — Т. 137, № 1. — С. 169-76. — doi:10.1242/dev.044867.
- ↑ Marshal E. Lieberfarb, Tehyen Chu, Christopher Wreden, William Theurkauf, J. Peter Gergen, Sidney Strickland. [http://dev.biologists.org/content/122/2/579.abstract Mutations that perturb poly(A)-dependent maternal mRNA activation block the initiation of development] // Development. — 1996. — С. 579-588.
- ↑ Alexander Spirov, Khalid Fahmy, Martina Schneider, Erich Frei, Markus Noll and Stefan Baumgartner. Formation of the bicoid morphogen gradient: an mRNA gradient dictates the protein gradient // Development. — 2009. — Т. 136. — С. 605-614.
- ↑ J.A. Drocco, E.F. Wieschaus, D.W. Tank. The synthesis-diffusion-degradation model explains Bicoid gradient formation in unfertilized eggs // Phys Biol. — 2012 ;. — Т. 9(5). — doi:10.1088/1478-3975/9/5/055004.
- ↑ Yurie Okabe-Oho,Hiroki Murakami, Suguru Oho,Masaki Sasai. Stable, Precise, and Reproducible Patterning of Bicoid and Hunchback Molecules in the Early Drosophila Embryo // PLoS Comput Biol. — 2009. — Т. 5, № 8. — doi:10.1371/journal.pcbi.1000486. Архивировано 13 декабря 2010 года.
- ↑ Dierk Niessing,Stephen Blanke, and Herbert Jäckle. Bicoid associates with the 5′-cap-bound complex of caudal mRNA and represses translation // Genes Dev.. — 2002. — Т. 16, № 19. — С. 2576–2582. — doi:10.1101/gad.240002.
- ↑ Michael Stauber, Herbert Jäckle, and Urs Schmidt-Ott. The anterior determinant bicoid of Drosophila is a derived Hox class 3 gene // Proc Natl Acad Sci U S A.. — 1999. — Т. 96, № 7. — С. 3786–3789. Архивировано 21 августа 2022 года.
- ↑ St Johnston D, Driever W, Berleth T, Richstein S, Nüsslein-Volhard C. Multiple steps in the localization of bicoid RNA to the anterior pole of the Drosophila oocyte // Development. — 1989. — № 107.
- ↑ Reinitz J, Mjolsness E, Sharp DH. Model for cooperative control of positional information in Drosophila by bicoid and maternal hunchback. // J Exp Zool. — 1995. — Т. 271, № 1. — С. 47-56.
- ↑ Small S, Kraut R, Hoey T, Warrior R, Levine M. Transcriptional regulation of a pair-rule stripe in Drosophila // Genes Dev. — 1991. — Т. 5(5). — С. 827-39.
- ↑ Driever W, Siegel V, Nüsslein-Volhard C. Autonomous determination of anterior structures in the early Drosophila embryo by the bicoid morphogen // Development. — 1990. — Т. 109, № 4. — С. 811-20.
- ↑ Aude Porcher and Nathalie Dostatni. The Bicoid Morphogen System Minireview (англ.) // Current Biology. — Elsevier, 2010. — Т. 20, № 5. — С. 249-254. — doi:10.1016/j.cub.2010.01.026. Архивировано 19 декабря 2014 года.
Литература
- Gilbert S.F. Developmental biology (7th ed.). — 2003. — С. 575–585. — ISBN 0-87893-258-5.
- Дондуа А. К. Биология развития. Клеточные и молекулярные аспекты индивидуального развития. — Издательство СПбГУ, 2005. — Т. 2. — ISBN 5-288-03474-2.