Цепная реакция (химия)
Цепная реакция в химии — реакция, в ходе которой исходные вещества вступают в цепь превращений с участием промежуточных активных частиц (интермедиатов) и их регенерацией в каждом элементарном акте реакции.
История
Впервые термин «Цепная реакция» был предложен немецким химиком и физиком Максом Боденштейном, который в 1913 г. обнаружил, что в некоторых фотохимических реакциях (например, реакция водорода с хлором с образованием хлороводорода и оксида углерода с хлором с образованием фосгена) поглощение одного фотона приводит к взаимодействию сотен тысяч молекул исходных веществ. Поскольку уже тогда было понимание того, что каждый фотон способен поглотиться только одной частицей, был сделан вывод, что остальная цепь превращений вызывается активными частицами без дальнейшего участия квантов света. В качестве такой активной частицы Боденштейн предложил возбуждённую молекулу хлора Cl2*, а в 1916 г. другой немецкий химик В. Нернст предположил, что активные частицы имеют атомарную природу. Он также предложил последовательную схему реакции молекул водорода и хлора (неразветвлённая цепная реакция):
- [math]\displaystyle{ \mathsf{Cl_2 \xrightarrow[]{h\nu} 2Cl\cdot} }[/math]
- [math]\displaystyle{ \mathsf{Cl\cdot + H_2 \rightarrow HCl + H\cdot} }[/math]
- [math]\displaystyle{ \mathsf{H\cdot + Cl_2 \rightarrow HCl + Cl\cdot} }[/math]
Последовательная цепь превращений, в которых сохраняется активная частица (Cl• или H•), может вовлечь очень много молекул исходных реагентов (Cl2 и H2), при этом брутто-формула реакции отражает стехиометрию реакции:
- [math]\displaystyle{ \mathsf{H_2 + Cl_2 \rightarrow 2HCl} }[/math]
В 1926 г. советский физико-химик Ю. Б. Харитон, изучавший взаимодействие фосфора и кислорода при низких давлениях, обнаружил, что пары фосфора воспламеняются в некотором диапазоне давлений кислорода, и при понижении давления горение прекращается. Однако добавление инертного газа при этом пониженном давлении вызывает вспышку паров фосфора. Такое аномальное поведение реагентов — резкий переход от инертности к бурной реакции — противоречило тогдашним представлениям о химической кинетике, и выводы Харитона были подвергнуты критике Боденштейном. Н. Н. Семёнов, воспроизведя эксперимент Харитона, полностью повторил его результаты и открыл дополнительно зависимость реакционной способности фосфора от объёма сосуда. Найденные зависимости привели Семёнова и его коллег к открытию гибели активных частиц на стенках сосуда и понятия о разветвлённых цепных реакциях. Выводы Семёнова, опубликованные в 1927 г., были признаны Боденштейном, а в 1928 г. Семёнов и Рябинин обнаружили аналогичное поведение паров серы в кислороде. В этом же году С. Хиншелвуд опубликовал работу по исследованию верхнего предела при окислении смесей водорода с кислородом. На рубеже 1920—1930-х гг. Семёнов показал радикальный механизм цепного процесса и описал основные его черты. В 1963 году совместно с А. Е. Шиловым он установил роль энергетических процессов в развитии цепных реакций при высоких температурах. За разработку теории цепных реакций в 1956 году Семёнов вместе с Хиншелвудом был удостоен Нобелевской премии по химии.
Теория цепных реакций
Признаки цепных реакций
- Реакция ускоряется в присутствии инициаторов, причём распад одной молекулы инициатора приводит к превращению нескольких молекул реагирующих веществ.
- Реакция инициируется при действии света или ионизирующего излучения, причём квантовый выход больше 1.
- Реакция тормозится ингибиторами, а скорость расхода ингибитора гораздо меньше скорости неингибированной реакции.
Терминология
- Активные центры
Цепная реакция протекает с участием активных центров — свободных радикалов, атомов, возбуждённых молекул, которые участвуют в цепном процессе. Реакцию может вести как один активный центр (например, в случае радикальной полимеризации):
- [math]\displaystyle{ \mathsf{\text{-}CH_2\text{-}CH(X)\cdot + CH_2\text{=}CH\text{-}X \rightarrow \text{-}CH_2\text{-}CH(X)\text{-}CH_2\text{-}CH(X)\cdot} }[/math]
либо несколько, например, в реакциях сульфоокисления:
- [math]\displaystyle{ \mathsf{R\cdot + SO_2 \rightarrow RSO_2\cdot} }[/math]
- [math]\displaystyle{ \mathsf{RSO_2\cdot + O_2 \rightarrow RSO_4\cdot} }[/math]
- [math]\displaystyle{ \mathsf{RSO_4\cdot + RH \rightarrow RSO_4H + R\cdot} }[/math]
- Инициирование (зарождение) цепи
Стадия инициирования цепи заключается в образовании активной частицы, как правило, с разрывом химической связи. Данная стадия является самой энергоёмкой и протекает при высоких температурах, воздействии света, ионизирующего излучения, ускоренных электронов, а также в присутствии инициаторов — веществ, у которых энергия разрыва химической связи значительно меньше энергии разрыва химической связи исходных реагентов. Подобными веществами могут служить различные радикальные инициаторы, например, азобисизобутиронитрил, бензоилпероксид, кумилгидропероксид и другие вещества, при нагревании которых происходит гомолитический разрыв связи с образованием активных радикалов, начинающих цепную реакцию.
Также инициаторами цепной реакции могут служить процессы с переносом электрона, например, реактив Фентона FeSO4 — H2O2:
- [math]\displaystyle{ \mathsf{Fe^{2+} + H_2O_2 \rightarrow Fe^{3+} + OH^- + HO\cdot} }[/math]
В отличие от катализаторов, инициаторы расходуются в ходе реакции.
- Продолжение цепи
Продолжение цепи заключается в реакции активных центров с молекулами исходных реагентов, в которых образуются продукты реакции и сохраняется активный центр. Продолжение цепи возможно вследствие выполнения принципа неуничтожимости свободной валентности в ходе взаимодействия активных центров с валентнонасыщенными молекулами.
- Звено цепи
Звеном цепи называют последовательность актов продолжения цепи, которые заканчиваются на исходном типе активного центра. В случае реакции хлора с водородом таких актов две, в реакции сульфоокисления — три.
- Обрыв цепи
При обрыве цепи происходит гибель активного центра. Исчезновение свободной валентности происходит в следующих случаях:
- квадратичный обрыв цепей вследствие взаимодействия двух активных центров друг с другом. При этом необходимо столкновение с третьей частицей, которая уносит энергию реакции
- [math]\displaystyle{ \mathsf{CH_3\cdot + CH_3\cdot \xrightarrow[]{M} H_3C\text{-}CH_3} }[/math]
- реакция активного центра с молекулой, при которой образуется малоактивный радикал, неспособный продолжать цепь — линейный гомогенный обрыв цепей
- [math]\displaystyle{ \mathsf{Cl\cdot + O_2 \rightarrow ClO_2} }[/math]
- реакция активного центра с поверхностью (например, сосуда или твёрдой частицы) — линейный гетерогенный обрыв цепей:
- [math]\displaystyle{ \mathsf{Cl\cdot + S \rightarrow S\text{-}Cl} }[/math]
- [math]\displaystyle{ \mathsf{Cl\cdot + S\text{-}Cl \rightarrow S + Cl_2} }[/math]
- Длина цепи
Длиной цепи называется полное число звеньев реакции продолжения цепи, которые приходятся на один радикал, образовавшийся при зарождении цепи. Если β — вероятность обрыва цепи, (1-β) — вероятность роста цепи, то длина цепи ν равна:
- [math]\displaystyle{ \mathsf{\nu = \frac{1-\beta}{\beta} = \frac{v_p}{v_t} } }[/math]
где vp — скорость реакции продолжения цепи, vt — скорость обрыва цепи. При достаточно большой длине цепи β мало, поэтому
- [math]\displaystyle{ \mathsf{\nu = \frac{1-\beta}{\beta} \approx \frac{1}{\beta}} }[/math]
- Разветвление цепи
В неразветвлённых цепных реакциях в каждом элементарном акте реакции из одного активного центра образуется один активный центр. Процесс образования нескольких активных центров во время элементарного акта реакции называется разветвлением цепи.
Кинетика неразветвлённых цепных реакций
Активные частицы, участвующие в цепной реакции, являются весьма активными и быстро реагируют с молекулами реагентов и друг с другом. В результате в системе устанавливается динамическое равновесие между скоростью образования активных частиц и скоростью их гибели, а концентрация активных центров R• становится квазистационарной:
- [math]\displaystyle{ \mathsf{\frac{dR\cdot}{dt} \approx 0} }[/math]
а скорость инициирования цепей vi равна скорости их обрыва vi:
- [math]\displaystyle{ \mathsf{v_i \approxeq v_t} }[/math]
В случае линейного обрыва цепей
- [math]\displaystyle{ \mathsf{R\cdot + M \xrightarrow[]{k_{t1}} RM\cdot} }[/math]
скорость реакции обрыва равна
- [math]\displaystyle{ \mathsf{v_{t1} = k_{t1}[R\cdot]} }[/math]
а квазистационарная концентрация радикалов R•
- [math]\displaystyle{ \mathsf{[R\cdot] = \frac{v_i}{k_{t1}}} }[/math]
Для квадратичного обрыва цепей
- [math]\displaystyle{ \mathsf{R\cdot + R\cdot \xrightarrow[]{k_{t2}} P} }[/math]
- [math]\displaystyle{ \mathsf{v_t = 2k_{t2}[R\cdot]^2} }[/math]
- [math]\displaystyle{ \mathsf{[R\cdot] = (\frac{v_i}{2k_{t2}})^{\frac{1}{2}}} }[/math]
Условие длинных цепей: скорость развития цепи vp много больше скорости инициирования и обрыва цепей. В этом случае при вычислении концентрации активных центров образованием и гибелью активных центров пренебрегают.
Для цепной реакции хлора с водородом
- [math]\displaystyle{ \mathsf{Cl\cdot + H_2 \xrightarrow[]{k_{p1}} HCl + H\cdot} }[/math]
- [math]\displaystyle{ \mathsf{H\cdot + Cl_2 \xrightarrow[]{k_{p2}} HCl + Cl\cdot} }[/math]
- [math]\displaystyle{ \mathsf{\frac{d[Cl\cdot]}{dt} = v_i + k_{p1}[H_2][Cl\cdot] - k_{p2}[Cl_2][H\cdot] - k_{t2}[M][Cl\cdot]^2 = 0} }[/math]
- [math]\displaystyle{ \mathsf{\frac{[Cl\cdot]}{[H\cdot]} = \frac{k_{p_2}[Cl_2]}{k_{p1}[H_2]}} }[/math]
Пример неразветвлённой цепной реакции — пиролиз этана:
Инициирование:
- [math]\displaystyle{ \mathsf{H_3CCH_3 \xrightarrow[]{k_0} 2CH_3\cdot} }[/math]
- [math]\displaystyle{ \mathsf{CH_3\cdot + C_2H_6\xrightarrow[]{} CH_4 + C_2H_5\cdot} }[/math]
Развитие цепи:
- [math]\displaystyle{ \mathsf{C_2H_5\cdot \xrightarrow[]{k_1} C_2H_4 + H\cdot} }[/math]
- [math]\displaystyle{ \mathsf{H\cdot + C_2H_6\xrightarrow[]{k_2} C + D} }[/math]
Обрыв цепи:
- [math]\displaystyle{ \mathsf{2C_2H_5\cdot \xrightarrow[]{k_3} C_2H_4 + C_2H_6} }[/math]
- [math]\displaystyle{ \mathsf{2C_2H_5\cdot \xrightarrow[]{k_3} C_4H_{10}} }[/math]
Условие длинных цепей:
- [math]\displaystyle{ \mathsf{k_1[C_2H_5\cdot] = k_2[C_2H_6][H\cdot]} }[/math]
- [math]\displaystyle{ \mathsf{\frac{[H\cdot]}{[C_2H_5\cdot]}=\frac{k_1}{k_2[C_2H_6]}} }[/math]
Кинетика разветвлённых цепных реакций
Кроме всех стадий, характерных для неразветвлённых цепных реакций, разветвлённые цепные реакции имеют одну и более стадий разветвления цепей, которые могут протекать по разным механизмам.
- Материальное разветвление
Такой вид разветвления наблюдается, например, в реакции горения водорода:
- [math]\displaystyle{ \mathsf{H\cdot + O_2 \rightarrow OH\cdot + O:} }[/math]
- [math]\displaystyle{ \mathsf{O: + H_2 \rightarrow HO\cdot + H\cdot} }[/math]
- Энергетическое разветвление
Наблюдается в случае образования высокоэнергетических частиц, в частности, в реакции водорода со фтором с образованием возбуждённой молекулы фтороводорода и переносом энергии с неё на молекулу водорода:
- [math]\displaystyle{ \mathsf{H\cdot + F_2 \rightarrow HF^* + F\cdot} }[/math]
- [math]\displaystyle{ \mathsf{HF^* + H_2 \rightarrow HF + H_2^*} }[/math]
- [math]\displaystyle{ \mathsf{H_2^* + F_2 \rightarrow HF + H\cdot + F\cdot} }[/math]
Для разветвлённых цепных реакций характерны стационарный и нестационарный режимы её протекания. В первом случае скорость стадии обрыва цепей выше скорости стадии разветвления, поэтому квазистационарная концентрация активных центров при небольшой глубине реакции сравнительно постоянна. Если же скорость разветвления цепей превышает скорость их обрыва, то концентрация активных центров в системе стремительно возрастает, и происходит цепной взрыв. Так же характерен переход цепного воспламенения в тепловой взрыв, если отвод тепла из системы затруднён.

Скорость и глубину реакции в нестационарном режиме часто выражают уравнением Семёнова:
- [math]\displaystyle{ \mathsf{v \sim Ae^{\varphi t} } }[/math]
где φ — фактор разветвления цепи: разность между скоростями разветвления и обрыва цепей в расчёте на один активный центр. Условие φ = 0 является граничным для перехода процесса в нестационарный режим.
Возможность перехода цепной разветвлённой реакции из стационарного режима в нестационарный определяется критическими условиями, в которых скорости разветвления и обрыва цепей равны. Такой переход наблюдается при изменении концентрации реагентов, температуры, размера сосуда, введении примесей и даже при разбавлении системы инертным газом.
Влияние давления в системе на режим газофазной разветвлённой цепной реакции определяется тремя зонами:
- Зона низких давлений — скорость обрыва цепей достаточно высока вследствие диффузии активных центров и их гибели на стенках сосудов, скорость реакции невысока
- Зона повышенных давлений — вследствие затруднённости диффузии активных центров и роста концентрации реагентов скорость разветвления цепей превышает скорость их обрыва, происходит ускорение реакции и воспламенение реакционной смеси — нижний предел самовоспламенения
- Зона высоких давлений — вследствие большой концентрации активных центров нарастает доля квадратичного обрыва цепей в тримолекулярных реакциях, и при некотором давлении реакция снова переходит в стационарный режим — верхний предел самовоспламенения.
С повышением температуры область воспламенения между нижним и верхним пределами воспламенения расширяется вследствие того, что повышается вероятность энергетического разветвления цепи, в то же время скорость обрыва цепи изменяется слабо. При понижении температуры нижний и верхний пределы воспламенения сливаются в одну точку. В итоге зависимость пределов воспламенения от температуры имеет характерный вид, называемый полуостровом воспламенения.
- Вырожденное разветвление
По данному механизму разветвления радикалы образуются из молекулярных продуктов реакции, и её можно рассматривать как систему, в которой накапливается инициатор, поскольку скорость его распада значительно меньше скорости передачи цепи. Подобный механизм наблюдается при окислении углеводородов кислородом воздуха (автоокисление) с образованием гидропероксидов:
- [math]\displaystyle{ \mathsf{RH + O_2 \rightarrow R\cdot + HOO\cdot} }[/math]
- [math]\displaystyle{ \mathsf{R\cdot + O_2 \rightarrow ROO\cdot} }[/math]
- [math]\displaystyle{ \mathsf{ROO\cdot + RH \rightarrow ROOH + R\cdot} }[/math]
- [math]\displaystyle{ \mathsf{ROOH \xrightarrow[]{k_3} RO\cdot + HO\cdot} }[/math]
- [math]\displaystyle{ \mathsf{RO\cdot + RH \rightarrow R\cdot + ROH} }[/math]
- [math]\displaystyle{ \mathsf{HO\cdot + RH \rightarrow R\cdot + H_2O} }[/math]
По мере образования и гомолитического распада гидропероксида скорость реакции возрастает — реализуется положительная обратная связь. Скорость реакции описывается уравнением
- [math]\displaystyle{ \mathsf{v=k_i[RH][O_2] = k_3[ROOH] } }[/math]
Ингибирование
Введение ингибиторов позволяет существенно замедлить радикально-цепные процессы. Применительно к реакциям автоокисления углеводородов по механизму действия ингибиторы подразделяются на 3 класса:
- Ингибиторы, взаимодействующие с пероксидными радикалами
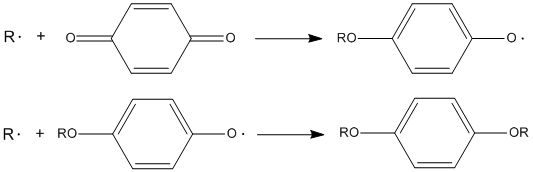
К таким ингибиторам относятся фенолы, ароматические амины, аминофенолы, гидроксиламины, а также полициклические ароматические углеводороды. Эти вещества способны обрывать 2 цепи цепного процесса с образованием малоактивного радикала и молекулярных продуктов:
- [math]\displaystyle{ \mathsf{InH + RO_2\cdot \rightarrow ROOH + In\cdot} }[/math]
- [math]\displaystyle{ \mathsf{In\cdot + RO_2\cdot \rightarrow P} }[/math]
- Ингибиторы, взаимодействующие с алкильными радикалами
Такими ингибиторами служат хиноны, нитроксильные радикалы, иод:
- [math]\displaystyle{ \mathsf{R_2NO\cdot + R_1\cdot \rightarrow R_2NOR_1} }[/math]
- [math]\displaystyle{ \mathsf{R\cdot + I_2 \rightarrow RI + I\cdot} }[/math]
- [math]\displaystyle{ \mathsf{R\cdot + I\cdot \rightarrow RI} }[/math]
- Ингибиторы, реагирующие с гидропероксидами
Скорость реакции автоокисления углеводородов возрастает при увеличении в них концентрации гидропероксидов, поэтому добавление веществ, реагирующих с гидропероксидами (например, сульфидов, дисульфиды) с образованием молекулярных продуктов процессы автоокисления существенно замедляются:
- [math]\displaystyle{ \mathsf{R_1OOH + R_2S \rightarrow R_1OH + R_2SO} }[/math]
- [math]\displaystyle{ \mathsf{R_1OOH + RSSR \rightarrow R_1OH + RS(O)SR} }[/math]
Литература
- Н. Н. Семёнов. Самовоспламенение и цепные реакции // Успехи химии. — Российская академия наук, 1967. — Т. 36, № 1. — С. 3—22.
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5 (Три-Ятр). — 783 с. — ISBN 5-85270-310-9.
- Е. Т. Денисов. Кинетика гомогенных химических реакций. — М.: Высшая школа, 1988. — 391 с. — 6000 экз. — ISBN 5-06-001337-5.
- Е. Т. Денисов, О. М. Саркисов, Г. И. Лихтенштейн. Химическая кинетика. — М.: Химия, 2000. — 568 с. — 1000 экз. — ISBN 5-7245-1062-6.