Тетраборат натрия
| Тетраборат натрия | |
|---|---|
  | |
  | |
| Общие | |
| Традиционные названия | бура, боракс |
| Хим. формула | Na2B4O7 |
| Физические свойства | |
| Состояние | кристаллы |
| Молярная масса | 201,22 г/моль |
| Термические свойства | |
| Температура | |
| • плавления |
664 °C (β-модификация) 710 °C (γ-модификация) |
| • кипения | 1575 °C |
| Химические свойства | |
| Растворимость | |
| • в воде |
3,2 г/100 мл (25 °C) 10,5 г/100 мл (50 °C) |
| • в этаноле | 0,05 (25 °C) |
| • в ацетоне | 0,006 (25 °C) |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
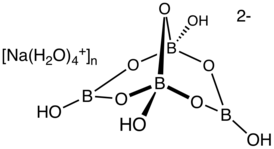
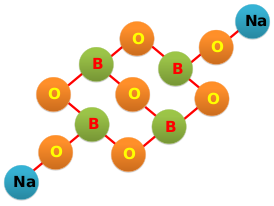
Тетрабора́т на́трия («бура́», «боракс» (от лат. borax), натрий тетраборнокислый) — неорганическое соединение, натриевая соль борной кислоты с химической формулой [math]\ce{ Na2B4O7 }[/math], наиболее распространённое и используемое соединение бора, образует несколько кристаллогидратов, широко применяется в промышленности.
Нахождение в природе
Существуют многочисленные минералы, содержащие тетраборат натрия. К ним относятся:
- бура (боракс, тинкал) — минерал состава [math]\ce{ Na2B4O7.10H2O }[/math] — декагидрат тетрабората натрия;
- кернит — тетрагидрат тетрабората натрия — [math]\ce{ Na2B4O7.4H2O }[/math];
- многочисленные минералы класса боратов, в которых помимо оксидов натрия и бора содержатся другие металлы, — кальций, магний, железо и др.;
- кристаллогидраты тетрабората натрия выпадают в осадок при пересыхании некоторых бессточных, сезонно пересыхающих солёных озёр, например, в озере Серлс, расположенном в пустыне Мохаве в США, и некоторых озёр в Турции.
Физические свойства
Имеет две метастабильные модификации: β и γ. β-модификация является ромбической с температурой плавления 664 °C, γ-модификация — моноклинная с температурой плавления 710 °C. Температура кипения — 1575 °C. При быстром охлаждении расплава образуется аморфная стекловидная масса с плотностью 2,36 г/см3[1]. При медленном охлаждении образуется α-форма (ромбические кристаллы)[2].
Химические свойства
Растворимость в воде составляет 3,2 г /100 мл (при 25 °C), 10,5 г / 100 мл (при 50 °C), в этаноле — 0,05 г / 100 г (при 25 °C), ацетоне — 0,006 г / 100 г (при 25 °C), не растворим в диэтиловом эфире и глицерине. Реагирует с метанолом при растворении с образованием бороорганических соединений[1].
Образует несколько кристаллогидратов с разным содержанием воды. Эти кристаллогидраты и безводный тетраборат натрия [math]\ce{ Na2B4O7 }[/math] обычно называют «бура́». Примеры кристаллогидратов:
- пентагидрат ([math]\ce{ Na2B4O7.5H2O }[/math]), так называемая «ювелирная бура», используется при пайке ювелирных изделий;
- декагидрат ([math]\ce{ Na2B4O7.10H2O }[/math]).
Однако наиболее часто «буро́й» называют декагидрат [math]\ce{ Na2B4O7.10H2O }[/math]. Эта соль представляет собой прозрачные кристаллы с молярной массой 381,43 г/моль, имеющие хорошую растворимость в тёплой воде[3]. При нагревании свыше 400 °C полностью теряет кристаллизационную воду.
Так как тетраборат натрия является солью слабой кислоты и сильного основания, в воде гидролизуется. Водный раствор тетрабората натрия имеет щелочную реакцию.
Взаимодействует с сильными кислотами, образуя соответствующую соль и борную кислоту:
- [math]\ce{ Na2B4O7.10H2O + 2 HCl -> 4 H3BO3 + 2 NaCl + 5 H2O }[/math].
Многие соли металлов борной кислоты нерастворимы в воде и при взаимодействии в растворе их растворимых солей с тетраборатом натрия образующиеся бораты выпадают в осадок. На этом основано применение буры для «умягчения» воды:
- [math]\ce{ Ca^2+_{(aq)}\ + Na2B4O7_{(aq)} -> CaB4O7_{(s)}\ + 2 Na^+_{(aq)} }[/math],
- [math]\ce{ Mg^2+_{(aq)}\ + Na2B4O7_(aq) -> MgB4O7_{(s)}\ + 2 Na^+_{(aq)} }[/math].
С оксидами многих переходных металлов бура при сплавлении образует разнообразно окрашенные соединения — бораты «перлы буры». По цвету перлов можно судить о качественном химическом составе пробы.
Соединение окрашивает пламя горелки в зелёный цвет (характерная реакция на соединения бора)[3].
Получение
Десятиводную соль [math]\ce{ Na2B4O7.10H2O }[/math] получают из природных минералов, например, буры или кернита, осуществляя их перекристаллизацию. Также для этой цели применяют химическое взаимодействие некоторых природных боратов (ашарита и улексита) с карбонатом или гидрокарбонатом натрия[1].
Может быть получен реакцией карбоната натрия и борной кислоты при нагреве, пропусканием углекислого газа через раствор метабората натрия[1].
Применение
Тетраборат натрия применяется:
- как сырьё для получения борной кислоты и различных соединений бора[1];
- в производстве эмалей, глазурей, оптических и цветных стёкол, различных керамик[1];
- при пайке и плавке металлов в составе флюса[1];
- при ковке металлов;
- в бумажной и фармацевтической промышленности;
- в производстве строительных материалов как компонент антисептика для изготовления целлюлозного утеплителя «Эковата»
- как дезинфицирующее и консервирующее средство[1];
- для приготовления буферных растворов;
- в аналитической химии:
- в фотографии — в составе медленно действующих проявителей в качестве слабого ускоряющего вещества[3];
- как компонент моющих средств[1];
- как компонент косметики;
- как инсектицид в отравленных приманках для уничтожения тараканов;
- используется в слаймах.
В 1977 году мировое производство тетрабората натрия составило 1,5 млн тонн[1].
Токсичность
Вещество малотоксично для теплокровных животных, ЛД50 для крыс 2,66 г/кг. Пыль может вызывать раздражение слизистых оболочек и неблагоприятно влияет на органы дыхания.
Имеются сведения, что вещество снижает фертильность. По нормам Европейского союза (ЕС) вещества и смеси, импортируемые в ЕС и содержащие буру, с июля 2015 года должны быть маркированы предупреждениями «Может нанести ущерб фертильности» и «Может нанести вред нерожденному ребёнку»[4].
Также указывается, что длительное, в течение 10—15 лет потребление буры в виде пищевых добавок может провоцировать онкологические заболевания[5].
См. также
Примечания
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 1,9 Федоров, 1992.
- ↑ Franz v Bruchhausen, Siegfried Ebel, Eberhard Hackenthal, Ulrike Holzgrabe. Hagers Handbuch der Pharmazeutischen Praxis: Folgeband 5: Stoffe L-Z. — Springer-Verlag, 2013. — 299 с. — ISBN 978-3-642-58388-9.
- ↑ 3,0 3,1 3,2 Иофис, 1981.
- ↑ Recommendation of the European Chemicals Agency of 1 July 2015 for the inclusion of substances in Annex XIV to REACH (List of Substances subject to Authorisation) Архивная копия от 14 июля 2015 на Wayback Machine Echa.europa.eu. Retrieved on July 6, 2015.
- ↑ Watch Out For The Food We Consume. Directorate of Consumer Protection, Jakarta, Indonesia (2006). Дата обращения: 10 февраля 2009. Архивировано 28 декабря 2008 года.
Литература
- Альмединген А. Н. Бура, фальсификация её // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Герценштейн Г. М. Бура, в медицине // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Натрия тетраборат // Фотокинотехника: Энциклопедия / Гл. ред. Е. А. Иофис. — М.: Советская энциклопедия, 1981. — С. 204. — 447 с.
- Левинсон-Лессинг Ф. Ю. Бура, нахождение в природе // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Федоров П. И. Натрия бораты // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди—Полимерные. — С. 180—181. — 639 с. — 48 000 экз. — ISBN 5-85270-039-8.
