Сиролимус
В статье не хватает ссылок на источники (см. также рекомендации по поиску). |
Стиль этой статьи неэнциклопедичен или нарушает нормы литературного русского языка. |
| Сиролимус | |
|---|---|
 | |
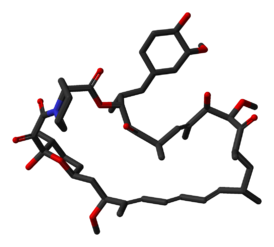 | |
| Химическое соединение | |
| Брутто-формула | C51H79NO13 |
| CAS | 53123-88-9 |
| Состав | |
| Классификация | |
| АТХ | L04AA10 |
Сиролимус, рапамицин — иммунодепрессант[1], применяемый для того, чтобы избежать отторжений органов при трансплантации[2][3]; часто он используется при почечных трансплантациях[4]. Он предотвращает активацию T и B клеток, подавляя их ответ на интерлейкины-2 (IL-2). Сиролимус активно используется при стентировании[5]. Он также показал эффективность при лечении аутоиммунных заболеваний у мышей[6].
История
История рапамицина началась в 1965 году, когда канадская экспедиция изучала остров Пасхи (Рапа Нуи на местном) у горы Рано Кау и собирала образцы почв. Образцы были заморожены и часть их оказалась у компании Ayerst. В ней работал Сурен Сегал (Suren Sehgal [7]), который в 1972 году, через 7 лет, выделил бактерию Streptomyces hygroscopicus, которая выделяла вещество с противогрибковым эффектом. Вещество назвали рапамицин. Название препарата произошло от туземного названия этого острова «Rapa Nui»[8]. Сурен родился в Пакистане, его отец был владельцем фармацевтического завода и у Сурена был с детства интерес к препаратам. Еще в 16 он поступил в университет, а после окончания научной работы, переехал в Канаду.
Несколько лет длились исследования, было обнаружено его мощное воздействие на иммунитет и многое другое. Однако Ayerst не заинтересовалась этим препаратом, из-за финансовых вопросов в 1983 году начались сокращения и монреальская лаборатория была закрыта, а большинство сотрудников уволено.
Был приказ уничтожить имеющиеся биологические образцы при закрытии компании. Но Сурен Сегал нарушил приказ и принес домой пакет с образцами Streptomyces hygroscopicus, которые хранились в его холодильнике. Сегала перевели в лабораторию в Принстоне, а сверток переехал с ним в упаковке с сухим льдом. После смены менеждмента (Wyeth выкупила Ayerst в 1987 году), Сегал убедил руководство продолжить работу над этой бактерией. Видимо он нашел аргументы и в 1999 году рапамицин был одобрен FDA и в сентябре 1999 был выпущен под торговым названием Rapamune[9].
Механизм действия
Рапамицин ингибирует mTOR, связываясь со своим рецептором, цитоплазматическим белком FKBP12 (FK-binding protein 12), после чего этот комплекс узнает домен FRB (FKBP12-Rapamycin Binding domain) mTOR комплекса 1 (mTORC1). Это связывание приводит к дестабилизации mTORC1[10], который должен регулировать аутофагию, контроль трансляции, транскрипционную регуляцию и некоторые другие функции, связанные с клеточным ростом и выживанием.
Также сиролимус подавляет ответ на интерлейкин-2 и, таким образом, препятствует активации T и B клеток, а значит и иммунному ответу.
Использование
Предотвращение отторжения трансплантируемых органов
Основным преимуществом рапамицина перед кальциневриновыми ингибиторами является низкая токсичность по отношению к почкам. Пациенты, принимающие кальциневриновые ингибиторы в течение длительного времени, часто страдали ослаблением функций почек или даже хронической почечной недостаточностью. Этих синдромов удалось избежать, используя сиролимус вместо кальциневриновых ингибиторов. Особенно этот эффект был заметен при трансплантации почек больным с Гемолитикоуремическим синдромом, так как болезнь часто рецидивировала в случае использования кальциневриновых ингибиторов. Как бы то ни было, 7 октября 2008 года, FDA выпустило предупреждение[источник не указан 3042 дня] о возможных нарушениях почечных функций, вызванных употреблением рапамицина. Также возможными побочными эффектами использования сиролимуса могут быть замедление заживления постоперацинных ран и тромбоцитопения. По этим причинам многие медицинские центры предпочитают назначать рапамицин не сразу после трансплантации, а только по прошествии нескольких недель.
Использование при стентировании
В разделе не хватает ссылок на источники (см. также рекомендации по поиску). |
Антипролиферативный эффект рапамицина также был использован для предотвращения рестеноза сосудов после их стентирования. Формирование слоя полимеризованного рапамицина на поверхности стентов уменьшает вероятность образования бляшек в стенированных сосудах и, следовательно, предотвращает их повторное сужение в период восстановления после операции. Тем не менее, предполагается, что такие стенты могут повышать вероятность риска сосудистого тромбоза.
Первые Сиролимус-выделяющие коронарные стенты начали выпускаться под маркой Cypher, сейчас выпускаются многими производителями.
Использование для биологических исследований
В разделе не хватает ссылок на источники (см. также рекомендации по поиску). |
Рапамицин используется в биологических исследованиях как агент для химически индуцированной димеризации. Для димеризации белков используются клеточные линии, экспрессирующие два гибридных белка, один из которых содержит FRB домен, а другой- FKBP домен. Такие гибридные белки димеризуются только в присутствии рапамицина. Этот метод позволяет контролировать и изучать локализацию и взаимодействия белков.
Побочные эффекты
Интерстициальный пневмонит
В разделе не хватает ссылок на источники (см. также рекомендации по поиску). |
Одним из побочных эффектов использования сиролимуса при легочной трансплантации является риск развития интерстициального пневмонита. Механизм этого явления пока недостаточно изучен.
Онкология
Как и любые иммунодепрессанты, рапамицин подавляет врожденные противораковые механизмы защиты нашего организма, что способствует развитию опухоли, которое было бы затруднено в обычных условиях. Есть данные, что у больных раком, принимавших рапамицин, скорость развития опухоли была выше, чем у больных с интактной иммунной системой. Тем не менее, многие научные работы указывают на то, что определенные дозы рапамицина могут усилить иммунный ответ организма на опухоли или даже вызвать их деградацию.
Диабетоподобные симптомы
Рапамицин способен ингибировать не только mTORC1 комплекс, но и родственный комплекс mTORC2. Нарушение функций mTORC2 может привести к «диабетоподобным» синдромам, таким как нечувствительность к инсулину и ухудшение переносимости глюкозы.
Биосинтез
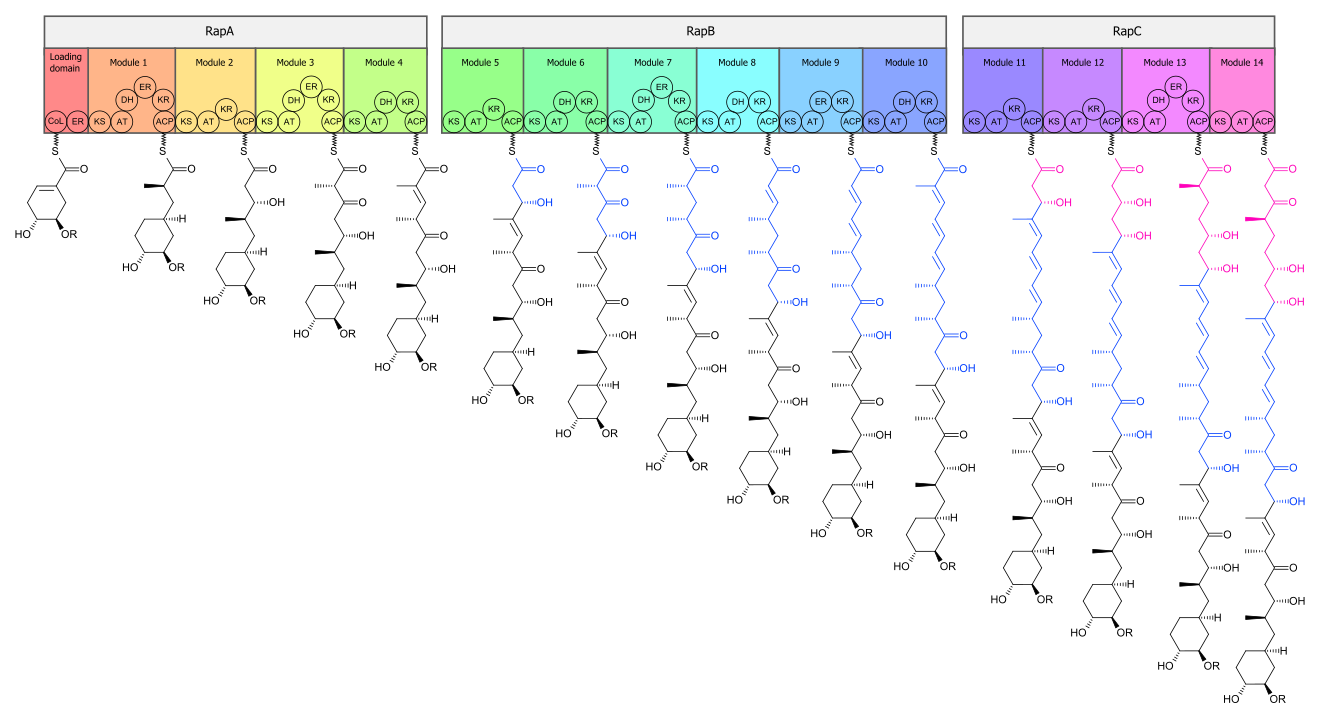
Биосинтез рапамицина осуществляется двумя мультиферментными комплексами: поликетидсинтазой 1 (PKS) и нерибосомальной пептидил синтазой (NRPS). PKS состоит из трех ферментных комплексов: RapA, RapB и RapC, которые организованы так, что первые 4 стадии элонгации поликетидной цепи происходят в RapA, следующие 6 стадий в RapB, а последние 4 стадии, завершающие синтез линейного поликетида происходят в RapC. Далее линейный поликетид модифицируется NRPS. RapP комплекс присоединяет L-пипеколат к терминальному концу поликетида, и поликетид циклизуется с образованием промежуточного продукта прерапамицина[11]
Далее прерапамицин (Рис. 2) претерпевает 5 превращений (Рис. 3), которые ведут к образованию окончательного продукта рапамицина. В начале, под действием RapI (SAM-зависимая O-метилтрансфераза (MTase)) прерапамицин O-метилируется по C39. Далее RapJ (цитохром P450 моноксигеназа) присоединяет карбонильную группу к C9. RapM, следующая MTase, O-метилирует C16. Далее RapN, ещё одна P450 моноксигеназа образует гидроксильную группу на C27, которая сразу же O-метилируется RapQ с получением рапамицина.
Исследования
Как было показано, сиролимус подавляет развитие кожной Саркомы Капоши у пациентов после пересадки почек. Есть данные, что рапамицин также может быть полезен при лечении туберозного склероза (TSC), врожденного заболевания, при котором у больных развиваются доброкачественные опухоли в мозгу, легких, почках, коже и других органах. Использование mTOR ингибиторов способствовало ремиссии TSC опухолей. По результатам исследований in vitro было высказано предположение, что рапамицин может подавлять распространение ВИЧ в организме, подавляя образование CCR5 рецепторов и способствуя аутофагии. В исследованиях на мышах было также замечено, что сиролимус препятствует развитию аутизма и болезни Альцгеймера.
Увеличение продолжительности жизни и жизнеспособности
В 2006 впервые было показано, что рапамицин продлевает жизнь эукариот[12].Изначально такой эффект наблюдался на дрожжевых клетках. Было подтверждено, что эффект рапамицина определяется его влиянием на TOR киназу, так как другие ингибиторы TOR также приводили к увеличению продолжительности жизни клеток в стационарной фазе.
Исследования проведенные на мышах
В 2009 году в публикации журнала Nature было показано увеличение максимальной продолжительности жизни у мышей[13]. В эксперименте кормили рапамицином в количестве 14 ppm как молодых (9 месячных), так и уже пожилых (20 месячных - эквивалент 60 человеческим годам) особей. Так было показано, что наибольшая продолжительность жизни мышей, которым давали рапамицин, повысилась в среднем на 9 % у самцов и 14 % у самок[13].
Таким образом, рапамицин является первым фармакологическим агентом, для которого было показано, что он увеличивает продолжительность жизни млекопитающих. И как показали исследования[13][14][15] этот эффект не зависит от пола животного.
Связь со скоростью старения
Увеличение продолжительности жизни не обязательно говорит о том, что старение замедлилось. Другим объяснением может быть ингибирование сокращающих жизнь патологий, таких как, например, злокачественные опухоли. Часто мыши умирают именно от злокачественных опухолей. Попытка понять почему мыши, которым давали рапамицин, живут дольше, показала, что основной причиной смерти (более 70%) у мышей являются именно опухоли. И рапамицин увеличивает продолжительность жизни благодаря своим антираковым свойствам, замедляя и ингибируя образование новых опухолей и разрастание старых[16][17][18].
В ходе старения большинство тканей и систем органов подвергаются характерным молекулярным, структурным и функциональным изменениям.
Влияние на кровеносную систему
Оказалось, что принятие сиролимуса животными в течение относительно продолжительного времени (в течение 1 года в концентрации для которой было увеличение продолжительности жизни - 14 ppm) приводит к уменьшению объема и веса сердца[19]. Также рапамицин способствует увеличению количества эритроцитов у мышей, имеющих фенотип с уменьшенным количеством красных кровяных телец, причем, независимо от возраста[19].
Влияние на скелет и сухожилия
Существует несколько характерных изменений (снижение трабекулярной костной системы и прогрессирование кифозных изменений в позвоночнике[20], происходящих в скелете организма в ходе его старения. Изучение этих признаков старения показало, что, похоже, рапамицин не влияет на скелет в целом и кости в частности, зато значительно улучшает биомеханические свойства сухожилий[20][21].
Влияние на двигательную активность
В ходе старения у мышей уменьшается желание разведывать территорию и в общем снижается двигательная активность[14][22]. Опыты, проведенные над молодыми (7 месяцев) и зрелыми (18 месяцев) особями, показали, что у мышей, которым давали рапамицин, моторные функции оказываются на более высоком уровне, чем у тех, кому его не давали[14]. Причем, это улучшение мышечной активности наблюдается как у молодых, так и взрослых особей.
Влияние на зрение
У мышей с возрастом появляются проблемы со зрением, развивается катаракта в передней части глаза (65)[источник не указан 3042 дня]. Как показали исследования, рапамицин не способствует улучшению зрения у пожилых особей, а, возможно, даже негативно воздействует на конкретные черты строения глаза (меняет его плотность).
Влияние на иммунитет
Оказалось, что у мышей рапамицин каким-то образом может влиять на количество Т клеток, причем похоже, что он может противодействовать возрастному изменению в их количестве[19]. Если говорить более подробно, то рапамицин способен приводить к уменьшению числа CD25+ CD4+ и CD44hi T клеток и увеличивать γδ популяцию.
Влияние на метаболизм
Было показано, что рапамицин способен увеличивать дыхательный обмен по крайней мере в одной из исследованных когорт[19], что, несомненно, заслуживает внимания и дальнейших исследований.
Существуют данные, что мыши, которые в эксперименте потребляли меньшее количество калорий на протяжении определенного периода времени, в среднем жили дольше[источник не указан 3042 дня]. Поэтому некоторыми предполагается, что рапамицин замедляет общий метаболизм мышей, влияя на них также, как малокалорийные диеты. Для мышей, которые переходили на малокалорийную диету в возрасте 20 месяцев, наблюдался меньший эффект на продление средней продолжительности жизни, чем в случае с рапамицином. Не исключено, что рапамицин также может быть использован как антивозрастной препарат для пожилых людей; это удобно, так как не требует употребления препарата на протяжении всей жизни. Тем не менее, не стоит забывать, что высокие дозы рапамицина могут подавлять иммунную систему человека, делая его более подверженным инфекциям.
Влияние на обучение и память
Использование классического физиологического опыта (лабиринта Барнса), показало, что рапамицин улучшает обучаемость и укрепляет память генетически измененных мышей[21].
Библиография
- Gibbons J.J., Abraham R.T., Yu K. Mammalian target of rapamycin: discovery of rapamycin reveals a signaling pathway important for normal and cancer cell growth (англ.) // Semin. Oncol. : journal. — 2009. — December (vol. 36 Suppl 3). — P. S3—S17. — doi:10.1053/j.seminoncol.2009.10.011. — PMID 19963098.
- Vézina C, Kudelski A, Sehgal SN (October 1975). "Rapamycin (AY-22,989), a new antifungal antibiotic". J. Antibiot. 28 (10): 721–6. doi:10.7164/antibiotics.28.721.PMID 1102508.
- Pritchard DI (2005). "Sourcing a chemical succession for cyclosporin from parasites and human pathogens". Drug Discovery Today 10 (10): 688–691. doi:10.1016/S1359-6446(05)03395-7. PMID 15896681.
- McAlister VC, Mahalati K, Peltekian KM, Fraser A, MacDonald AS. (June 2002). "A clinical pharmacokinetic study of tacrolimus and sirolimus combination immunosuppression comparing simultaneous to separated administration.". Ther Drug Monit. 24 (3): 346–50.doi:10.1097/00007691-200206000-00004. PMID 12021624.
- "Cypher Sirolimus-eluting Coronary Stent". Cypher Stent. Retrieved 2008-04-01.
- Shuchman M (2006). "Trading restenosis for thrombosis? New questions about drug-eluting stents". N Engl J Med 355 (19): 1949–52. doi:10.1056/NEJMp068234.PMID 17093244
- Delgado JF, Torres J, José Ruiz-Cano M, et al. (September 2006). "Sirolimus-associated interstitial pneumonitis in 3 heart transplant recipients". J. Heart Lung Transplant. 25 (9): 1171–4. doi:10.1016/j.healun.2006.05.013. PMID 16962483
Примечания
- ↑ http://www.cancer.gov/publications/dictionaries/cancer-drug?cdrid=42555 Архивная копия от 22 декабря 2015 на Wayback Machine NCI Drug Dictionary - sirolimus "A natural macrocyclic lactone produced by the bacterium Streptomyces hygroscopicus, with immunosuppressant properties."
- ↑ Thomas E. Glover, Christopher J. E. Watson, Paul Gibbs, J. Andrew Bradley, Evangelia E. Ntzani. Conversion From Calcineurin to Mammalian Target of Rapamycin Inhibitors in Liver Transplantation: A Meta-Analysis of Randomized Controlled Trials // Transplantation. — 2015-12-04. — ISSN 1534-6080. — doi:10.1097/TP.0000000000001006. Архивировано 25 января 2018 года.
- ↑ Farzaneh Ashrafi, Shahrzad Shahidi, Zeinab Ebrahimi, Mojgan Mortazavi. Outcome of rapamycin therapy for post-transplant-lymphoproliferative disorder after kidney transplantation: case series // International Journal of Hematology-Oncology and Stem Cell Research. — 2015-01-01. — Т. 9, вып. 1. — С. 26—32. — ISSN 2008-3009. Архивировано 2 декабря 2017 года.
- ↑ http://apps.who.int/medicinedocs/en/d/Js2266e/3.6.html Архивная копия от 22 декабря 2015 на Wayback Machine ".. The Food and Drug Administration has approved sirolimus ..new immunosuppressant drug, to prevent acute organ rejection in patients receiving kidney transplants, to be taken in conjunction with ciclosporin and corticosteroids."
- ↑ Anwer Habib, Vinit Karmali, Rohini Polavarapu, Hirokuni Akahori, Qi Cheng. Sirolimus-FKBP12.6 impairs endothelial barrier function through protein kinase C-α activation and disruption of the p120-vascular endothelial cadherin interaction // Arteriosclerosis, Thrombosis, and Vascular Biology. — 2013-10-01. — Т. 33, вып. 10. — С. 2425—2431. — ISSN 1524-4636. — doi:10.1161/ATVBAHA.113.301659. Архивировано 25 января 2018 года.
- ↑ Nicolas Prevel, Yves Allenbach, David Klatzmann, Benoit Salomon, Olivier Benveniste. Beneficial role of rapamycin in experimental autoimmune myositis // PloS One. — 2013-01-01. — Т. 8, вып. 11. — С. e74450. — ISSN 1932-6203. — doi:10.1371/journal.pone.0074450. Архивировано 25 января 2018 года.
- ↑ C. Vézina, A. Kudelski, S. N. Sehgal. Rapamycin (AY-22,989), a new antifungal antibiotic. I. Taxonomy of the producing streptomycete and isolation of the active principle // The Journal of Antibiotics. — 1975-10-01. — Т. 28, вып. 10. — С. 721—726. — ISSN 0021-8820. Архивировано 7 сентября 2017 года.
- ↑ rapamycin | drug | Britannica.com. Дата обращения: 18 декабря 2015. Архивировано 23 декабря 2015 года.
- ↑ Источник. Дата обращения: 18 декабря 2015. Архивировано 22 декабря 2015 года.
- ↑ Noriko Oshiro, Ken-ichi Yoshino, Sujuti Hidayat, Chiharu Tokunaga, Kenta Hara. Dissociation of raptor from mTOR is a mechanism of rapamycin-induced inhibition of mTOR function (англ.) // Genes to Cells. — 2004-04-01. — Vol. 9, iss. 4. — P. 359—366. — ISSN 1365-2443. — doi:10.1111/j.1356-9597.2004.00727.x. Архивировано 8 декабря 2015 года.
- ↑ T Schwecke, J F Aparicio, I Molnár, A König, L E Khaw. The biosynthetic gene cluster for the polyketide immunosuppressant rapamycin. (англ.) // Proceedings of the National Academy of Sciences. — 1995-08-15. — Vol. 92, iss. 17. — P. 7839–7843. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.92.17.7839.
- ↑ Mikhail V. Blagosklonny. Aging and immortality: quasi-programmed senescence and its pharmacologic inhibition // Cell Cycle (Georgetown, Tex.). — 2006-09-01. — Т. 5, вып. 18. — С. 2087—2102. — ISSN 1551-4005.
- ↑ 13,0 13,1 13,2 David E. Harrison, Randy Strong, Zelton Dave Sharp, James F. Nelson, Clinton M. Astle. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice (англ.) // Nature. — 2009-07-16. — Vol. 460, iss. 7253. — P. 392—395. — ISSN 0028-0836. — doi:10.1038/nature08221. Архивировано 25 мая 2021 года.
- ↑ 14,0 14,1 14,2 Richard A. Miller, David E. Harrison, C. M. Astle, Joseph A. Baur, Angela Rodriguez Boyd. Rapamycin, But Not Resveratrol or Simvastatin, Extends Life Span of Genetically Heterogeneous Mice // The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. — 2011-02-01. — Т. 66A, вып. 2. — С. 191—201. — ISSN 1079-5006. — doi:10.1093/gerona/glq178. Архивировано 25 января 2017 года.
- ↑ Richard A. Miller, David E. Harrison, Clinton M. Astle, Elizabeth Fernandez, Kevin Flurkey. Rapamycin-mediated lifespan increase in mice is dose and sex dependent and metabolically distinct from dietary restriction // Aging Cell. — 2014-06-01. — Т. 13, вып. 3. — С. 468—477. — ISSN 1474-9726. — doi:10.1111/acel.12194.
- ↑ Maria Comas, Ilia Toshkov, Karen K. Kuropatwinski, Olga B. Chernova, Alexander Polinsky. New nanoformulation of rapamycin Rapatar extends lifespan in homozygous p53−/− mice by delaying carcinogenesis // Aging (Albany NY). — 2012-10-29. — Т. 4, вып. 10. — С. 715—722. — ISSN 1945-4589. Архивировано 18 июня 2022 года.
- ↑ Mikhail V. Blagosklonny. Rapalogs in cancer prevention // Cancer Biology & Therapy. — 2012-12-01. — Т. 13, вып. 14. — С. 1349—1354. — ISSN 1538-4047. — doi:10.4161/cbt.22859.
- ↑ Vladimir N. Anisimov, Mark A. Zabezhinski, Irina G. Popovich, Tatiana S. Piskunova, Anna V. Semenchenko. Rapamycin Extends Maximal Lifespan in Cancer-Prone Mice // The American Journal of Pathology. — 2010-05-01. — Т. 176, вып. 5. — С. 2092—2097. — ISSN 0002-9440. — doi:10.2353/ajpath.2010.091050. Архивировано 4 мая 2022 года.
- ↑ 19,0 19,1 19,2 19,3 Frauke Neff, Diana Flores-Dominguez, Devon P. Ryan, Marion Horsch, Susanne Schröder. Rapamycin extends murine lifespan but has limited effects on aging // The Journal of Clinical Investigation. — 2013-08-01. — Т. 123, вып. 8. — С. 3272—3291. — ISSN 0021-9738. — doi:10.1172/JCI67674. Архивировано 14 мая 2016 года.
- ↑ 20,0 20,1 James M. Flynn, Monique N. O’Leary, Christopher A. Zambataro, Emmeline C. Academia, Michael P. Presley. [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4098908/ Late-life rapamycin treatment reverses age-related heart dysfunction] // Aging cell. — 2013-10-01. — Т. 12, вып. 5. — С. 851—862. — ISSN 1474-9718. — doi:10.1111/acel.12109. Архивировано 6 мая 2021 года.
- ↑ 21,0 21,1 J. Julie Wu, Jie Liu, Edmund B. Chen, Jennifer J. Wang, Liu Cao. Increased mammalian lifespan and a segmental and tissue-specific slowing of aging following genetic reduction of mTOR expression // Cell reports. — 2013-09-12. — Т. 4, вып. 5. — С. 913—920. — ISSN 2211-1247. — doi:10.1016/j.celrep.2013.07.030.
- ↑ John E. Wilkinson, Lisa Burmeister, Susan V. Brooks, Chi-Chao Chan, Sabrina Friedline. Rapamycin slows aging in mice // Aging cell. — 2012-08-01. — Т. 11, вып. 4. — С. 675—682. — ISSN 1474-9718. — doi:10.1111/j.1474-9726.2012.00832.x. Архивировано 8 сентября 2018 года.
Ссылки
- Рапамицин замедляет старение у мышей — «Элементы», Александр Марков, 15.07.2009