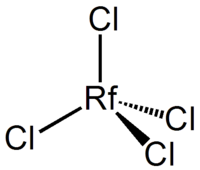Резерфордий
| Резерфордий | ||||
|---|---|---|---|---|
| ← Лоуренсий | Дубний → | ||||
| ||||
| Свойства атома | ||||
| Название, символ, номер | Резерфордий / Rutherfordium (Rf), 104 | |||
| Атомная масса (молярная масса) |
267 а. е. м. (г/моль) | |||
| Электронная конфигурация | [Rn]5f14 6d2 7s2 | |||
| Химические свойства | ||||
| Степени окисления | +4 | |||
| 104 | Резерфордий
|
| 5f146d27s2 | |
Резерфо́рдий (Rf), лат. Rutherfordium, до 1997 года в СССР и России был известен как курчато́вий (Ku) — 104-й элемент в периодической системе. Резерфордий — высокорадиоактивный искусственно синтезированный элемент, период полураспада наиболее стабильного из известных изотопов (267Rf) составляет около 1,3 часов. Этот элемент не может где-либо использоваться и про него мало что известно, поскольку он никогда не был получен в макроскопических количествах. Резерфордий — первый трансактиноидный элемент, его предсказанные химические свойства близки к гафнию.
История
Впервые сто четвёртый элемент периодической системы был синтезирован в 1964 году учёными Объединённого института ядерных исследований в Дубне под руководством Г. Н. Флёрова. Они обстреливали мишень из плутония-242 ядрами неона-22 энергией около 115 МэВ:
- [math]\displaystyle{ \mathrm{^{242}_{94}{Pu}+^{22}_{10}Ne\rarr ^{264}_{104}Rf^*}\begin{matrix} \nearrow\mathrm{^{260}_{104}Rf+4^1_0n} \\ \searrow\mathrm{^{259}_{104}Rf+5^1_0n} \end{matrix} }[/math]
Образовавшиеся атомы 104-го элемента попадали в среду газообразного хлорида циркония, где связывались с хлором и переносились к детекторам спонтанного деления.
Удалось выделить в наблюдаемом спонтанном делении два периода полураспада — 0,1 и 3,5 с, а также количественно оценить химические свойства элемента — температуру кипения RfCl4, равную 450±50°. Это достижение было признано как научное открытие и занесено в Государственный реестр открытий СССР под № 37 с приоритетом от 9 июля 1964 года[1]. В дальнейшем первый из указанных периодов полураспада не подтвердился (260Rf имеет период полураспада 21 мс), тогда как второй соответствует 259Rf (по современным данным 2,8 с).
В 1969 году элемент был получен группой учёных в Университете Беркли, Калифорния, которые утверждали, что не смогли повторить эксперименты советских учёных. Они использовали мишень из калифорния-249, которую облучали ионами углерода-12[2]:
- [math]\displaystyle{ \mathrm{^{249}_{98}{Cf}+^{12}_6C\rarr ^{261}_{104}Rf^*\rarr ^{257}_{104}Rf+4^1_0n} }[/math]
Синтез по американской методике был независимо подтверждён в 1973 году идентификацией резерфордия как источника наблюдаемых Kα-рентгеновских линий, свидетельствующих об образовании продукта распада резерфордия — нобелия-253[3].
В 1974 году в Объединённом институте ядерных исследований получили резерфордий в реакции холодного слияния атомов свинца-208 и титана-50[4]:
- [math]\displaystyle{ \mathrm{^{208}_{82}Pb+^{50}_{22}Ti\rarr ^{258}_{104}Rf^*}\begin{matrix} \nearrow\mathrm{^{255}_{104}Rf+3^1_0n} \\ \rarr\mathrm{^{256}_{104}Rf+2^1_0n}\\ \searrow\mathrm{^{257}_{104}Rf+^1_0n} \end{matrix} }[/math]
В 1970 году исследователи из Калифорнийского университета под руководством Альберта Гиорсо получили резерфордий-261 в реакции слияния ядер кюрия-248 и кислорода-18[5]:
- [math]\displaystyle{ \mathrm{^{248}_{96}Cm + ^{18}_8O\rarr ^{266}_{104}Rf^*\rarr ^{261}_{104}Rf+5^1_0n} }[/math]
В 1996 году в Беркли был получен изотоп резерфордий-262 при облучении плутония-244 ионами неона-22[6]:
- [math]\displaystyle{ \mathrm{^{244}_{94}Pu + ^{22}_{10}Ne\rarr ^{266}_{104}Rf^*}\rarr \begin{cases} \mathrm{^{261}_{104}Rf+5^1_0n} \\ \mathrm{^{262}_{104}Rf+4^1_0n} \end{cases} }[/math]
В 1999 году был открыт изотоп резерфордий-263 при электронном захвате дубния-263[7].
В 2000 году физикам из Дубны удалось получить резерфордий при облучении мишени из урана-238 ионами магния-26[8]:
- [math]\displaystyle{ \mathrm{^{238}_{92}U+^{26}_{12}Mg\rarr ^{264}_{104}Rf^*}\rarr\begin{cases} \mathrm{^{261}_{104}Rf+3^1_0n} \\ \mathrm{^{260}_{104}Rf+4^1_0n}\\ \mathrm{^{259}_{104}Rf+5^1_0n} \\ \mathrm{^{258}_{104}Rf+6^1_0n} \end{cases} }[/math]
Происхождение названия
Советские учёные, первыми заявившие о синтезе нового элемента, предложили название курчатовий (Kurchatovium, Ku) в честь выдающегося советского учёного-физика И. В. Курчатова[9].
В 1992 году совместная рабочая группа Международного союза теоретической и прикладной химии и Международного союза теоретической и прикладной физики по трансфермиевым элементам (англ. Transfermium Working Group) оценила заявки об открытии элемента 104 и сделала вывод, что обе группы привели достаточные доказательства его синтеза и честь открытия должна быть разделена между ними[10].
Американцы ответили на выводы комиссии, заявив, что она придаёт слишком большое значение результатам группы Объединённого института ядерных исследований. В частности, они указали, что за 20 лет советские учёные несколько раз изменяли детали своих заявлений о свойствах нового элемента, что советские учёные и не отрицали. Они также обвинили TWG в том, что та чересчур доверяет химическим опытам, проведённым советскими учёными, и что в комиссии нет квалифицированных специалистов. TWG ответила, что это не имеет значения и что они учли все возражения, приведённые американской группой, и заявили, что не находят причин для пересмотра их заключения о приоритете открытия[11]. В конце концов, ИЮПАК использовал название, предложенное американцами[12], что может некоторым образом указывать на то, что они изменили своё решение.
В 1994 году Международный союз теоретической и прикладной химии предложила название «дубний», поскольку название «резерфордий» было предложено для 106-го элемента, и Международный союз теоретической и прикладной химии считал, что группа Объединённый институт ядерных исследований должна быть достойно почтена за их вклад. Однако на этом спор по поводу названий для элементов 104—107 не закончился. Только в 1997 году дискуссия была завершена, и для 104-го элемента было принято текущее название «резерфордий», а для элемента 105 — название «дубний».
Название «резерфордий» в честь выдающегося английского физика Эрнеста Резерфорда было принято Международным союзом теоретической и прикладной химии в 1997 году (одно время «резерфордием» назывался 106-й элемент — сиборгий). До принятия этого названия элемент назывался «уннильквадием», обозначение Unq (в соответствии с общим соглашением о наименовании элементов, названия которых пока не утверждены, от латинских названий цифр 1, 0 и 4).
Химические свойства
Ранние расчёты показывали[когда?], что релятивистские эффекты в электронных оболочках резерфордия могут быть достаточно сильными, чтобы p-орбитали имели меньший уровень энергии, нежели d-орбитали, что делало бы его химические свойства похожими на свойства свинца. Но более точные расчёты и изучение полученных соединений показали, что он ведёт себя, как и остальные элементы IV группы.
Химические свойства резерфордия были определены с использованием ультрамалых количеств вещества чешским химиком Иво Звара. Было установлено, что 104 элемент химически является аналогом гафния. В степени окисления +4 он образует летучие при температурах 250—300 °C галогениды RfCl4 и RfBr4[13]. При экстракционных процессах с участием сложных комплексных ионов поведение резерфордия значительно отличается от поведения ионов трёхвалентных актиноидов и свидетельствует о существовании в этих системах иона Rf4+, что доказывает его сходство с гафнием[7].
Изотопы
На начало 2016 года известно 16 изотопов резерфордия (а также 4 ядерных изомера) с массовыми числами от 253 до 270 и периодом полураспада от долей микросекунд до 1,3 часов (267Rf).
Примечания
- ↑ Научные открытия России.. Дата обращения: 28 января 2011. Архивировано 22 апреля 2012 года.
- ↑ A. Ghiorso, M. Nurmia, J. Harris, K. Eskola, P. Eskola. Positive Identification of Two Alpha-Particle-Emitting Isotopes of Element 104 // Physical Review Letters. — 1969. — Т. 22, № 24. — С. 1317–1320. — doi:10.1103/PhysRevLett.22.1317.
- ↑ C. E. Bemis, et al. X-Ray Identification of Element 104 // Physical Review Letters. — 1973. — Т. 31, № 10. — С. 647–650. — doi:10.1103/PhysRevLett.31.647.
- ↑ Yu. Ts. Oganessian. Experiments on the synthesis of neutron-deficient kurchatovium isotopes in reactions induced by 50Ti Ions // Nuclear Physics A. — 1975. — Т. 38, № 6. — С. 492–501. — doi:10.1016/0375-9474(75)91140-9.
- ↑ A. Ghiorso, M. Nurmia, K. Eskola, P. Eskola. 261Rf; new isotope of element 104 // Physics Letters B. — 1970. — Т. 32, № 2. — С. 95–98. — doi:10.1016/0370-2693(70)90595-2.
- ↑ M. R. Lane, et al. Spontaneous fission properties of 104262Rf // Physics Letters C. — 1996. — Т. 53, № 6. — С. 2893–2899. — doi:10.1103/PhysRevC.53.2893.
- ↑ 7,0 7,1 J. V. Kratz. Critical evaluation of the chemical properties of the transactinide elements (IUPAC Technical Report) // Pure and Applied Chemistry. — 2003. — Т. 75, № 1. — С. 103. — doi:10.1351/pac200375010103. Архивировано 26 июля 2011 года.
- ↑ Yu. Lazarev, et al. Decay properties of 257No, 261Rf, and 262Rf // Physical Review C. — 2000. — Т. 62, № 6. — doi:10.1103/PhysRevC.62.064307.
- ↑ Г. Н. Флеров «Синтез и поиск трансурановых элементов». Журнал «Природа» № 9. 1972 г.
- ↑ Discovery of the transfermium elements. Part II: Introduction to discovery profiles. Part III: Discovery profiles of the transfermium elements // Pure and Applied Chemistry. — 1993. — Т. 65, № 8. — С. 1757–1814. — doi:10.1351/pac199365081757.
- ↑ A. Ghiorso, G. T. Seaborg, Yu. Ts. Organessian, I. Zvara, P. Armbruster, F. P. Hessberger, S. Hofmann, M. Leino, G. Munzenberg, W. Reisdorf, K.-H. Schmidt. Responses on 'Discovery of the transfermium elements' by Lawrence Berkeley Laboratory, California; Joint Institute for Nuclear Research, Dubna; and Gesellschaft fur Schwerionenforschung, Darmstadt followed by reply to responses by the Transfermium Working Group // Pure and Applied Chemistry. — 1993. — Т. 65, № 8. — С. 1815–1824. — doi:10.1351/pac199365081815.
- ↑ Names and symbols of transfermium elements (IUPAC Recommendations 1997) // Pure and Applied Chemistry. — 1997. — Т. 69, № 12. — С. 2471–2474. — doi:10.1351/pac199769122471.
- ↑ Gäggeler, Heinz W. Lecture Course Texas A&M: Gas Phase Chemistry of Superheavy Elements (PDF) (недоступная ссылка) (5 ноября 2007). Дата обращения: 30 марта 2010. Архивировано 22 июня 2012 года.