Полимеразная цепная реакция
Полимера́зная цепна́я реа́кция (ПЦР) — метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК или РНК) в биологическом материале (пробе).
Помимо амплификации ДНК, ПЦР позволяет производить множество других манипуляций с нуклеиновыми кислотами (введение мутаций, сращивание фрагментов ДНК) и широко используется в биологической и медицинской практике, например, для диагностики заболеваний (наследственных, инфекционных), для установления отцовства, для клонирования генов, выделения новых генов.
История
В начале 1970-х годов норвежский учёный Хьелль Клеппе из лаборатории нобелевского лауреата Хара Гобинды Кораны предложил способ амплификации ДНК с помощью пары коротких одноцепочечных молекул ДНК — синтетических праймеров[1]. Однако в то время эта идея осталась нереализованной. Полимеразная цепная реакция (ПЦР) была изобретена в 1983 году американским биохимиком Кэри Муллисом[2][3]. Его целью было создание метода, который бы позволил амплифицировать ДНК в ходе многократных последовательных удвоений исходной молекулы ДНК с помощью фермента ДНК-полимеразы. Первая публикация по методу ПЦР появилась в ноябре 1985 года в журнале Science[4]. Метод революционизировал молекулярную биологию и медицину. В 1993 году Кэри Муллис получил за это Нобелевскую премию по химии[5].
В начале использования метода после каждого цикла нагревания-охлаждения приходилось добавлять в реакционную смесь ДНК-полимеразу, так как она инактивировалась при высокой температуре, необходимой для разделения цепей спирали ДНК. Процедура проведения реакции была сравнительно неэффективной, требовала много времени и фермента. В 1986 году метод полимеразной цепной реакции был существенно улучшен. Было предложено использовать ДНК-полимеразы из термофильных бактерий[6]. Эти ферменты оказались термостабильными и были способны выдерживать множество циклов реакции. Их использование позволило упростить и автоматизировать проведение ПЦР. Одна из первых термостабильных ДНК-полимераз была выделена из бактерий Thermus aquaticus и названа Taq-полимеразой. Недостаток этой полимеразы заключается в довольно высокой вероятности внесения ошибочного нуклеотида, так как у этого фермента отсутствуют механизмы исправления ошибок (3'→5'-экзонуклеазная активность). Полимеразы Pfu и Pwo, выделенные из архей, таким механизмом обладают; их использование значительно уменьшает число мутаций в ДНК, но скорость их работы (процессивность) ниже, чем у Taq. Сейчас применяют смеси Taq и Pfu, чтобы добиться одновременно высокой скорости полимеризации и высокой точности копирования.
В момент изобретения метода Кэри Муллис работал химиком-синтетиком (он синтезировал олигонуклеотиды, которые применялись тогда для выявления точечных мутаций методом гибридизации с геномной ДНК) в компании Цетус Корпорейшн, которая и запатентовала метод ПЦР. В 1992 году Цетус продала права на метод и патент на использование Taq-полимеразы компании Хофман-Ла Рош за 300 млн долларов. Однако оказалось, что Taq-полимераза была охарактеризована советскими биохимиками А. Калединым, А. Слюсаренко и С. Городецким в 1980 году[7], а также за 4 года до этой советской публикации, то есть в 1976 году, американскими биохимиками Alice Chien, David B. Edgar и John M. Trela[8]. В связи с этим компания Promega пыталась в судебном порядке заставить Рош отказаться от исключительных прав на этот фермент[9]. Американский патент на метод ПЦР истёк в марте 2005 года.
Проведение ПЦР
Метод основан на многократном избирательном копировании определённого участка нуклеиновой кислоты ДНК при помощи ферментов в искусственных условиях (in vitro). При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. В отличие от амплификации ДНК в живых организмах (репликации), с помощью ПЦР амплифицируются относительно короткие участки ДНК. В обычном ПЦР-процессе длина копируемых ДНК-участков составляет не более 3000 пар оснований (3 kbp[10]). С помощью смеси различных полимераз, с использованием добавок и при определённых условиях длина ПЦР-фрагмента может достигать 20—40 тысяч пар нуклеотидов. Это всё равно значительно меньше длины хромосомной ДНК эукариотической клетки. Например, длина самой короткой ядерной хромосомы у человека (21-ая хромосома) составляет 46,71 миллионов пар оснований[11].
Компоненты реакции
Для проведения ПЦР в простейшем случае требуются следующие компоненты:
- ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать.
- Два праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК.
- Термостабильная ДНК-полимераза — фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfu-полимераза), Pyrococcus woesei (Pwo-полимераза), Thermus thermophilus (Tth-полимераза) и другие.
- Дезоксирибонуклеозидтрифосфаты (dATP, dGTP, dCTP, dTTP).
- Ионы Mg2+, необходимые для работы полимеразы.
- Буферный раствор, обеспечивающий необходимые условия реакции — рН, ионную силу раствора. Содержит соли, бычий сывороточный альбумин.
Чтобы избежать испарения реакционной смеси, в пробирку добавляют высококипящее масло, например, вазелиновое. Если используется амплификатор с подогревающейся крышкой, этого делать не требуется.
Добавление пирофосфатазы может увеличить выход ПЦР. Этот фермент катализирует гидролиз пирофосфата, побочного продукта присоединения нуклеозидтрифосфатов к растущей цепи ДНК, до ортофосфата. Пирофосфат может ингибировать ПЦР[12].
Праймеры
Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами, короткими синтетическими олигонуклеотидами длиной 18—30 оснований. Каждый из праймеров комплементарен одной из цепей двуцепочечной матрицы и ограничивает начало и конец амплифицируемого участка.
После гибридизации матрицы с праймером (отжиг[13]), последний служит затравкой для ДНК-полимеразы при синтезе комплементарной цепи матрицы (см. ниже).
Важнейшая характеристика праймеров — температура плавления (Tm) комплекса праймер-матрица.
Tm — температура, при которой половина ДНК-матриц образует комплекс с олигонуклеотидным праймером. Усреднённая формула подсчёта Tm для короткого олигонуклеотида (и для длинных фрагментов ДНК), с учётом концентрации ионов K+ и DMSO:
- [math]\displaystyle{ T_m = 77,1+11,7\lg[K^+]+\frac{41(G+C)- 528}{L}-0,75[\%DMSO] }[/math],[14]
где [math]\displaystyle{ L }[/math] — количество нуклеотидов в праймере, [math]\displaystyle{ K^+ }[/math] — молярная концентрация ионов калия, [math]\displaystyle{ G+C }[/math] — сумма всех гуанинов и цитозинов.
В случае неверного выбора длины и нуклеотидного состава праймера или температуры отжига возможно образование частично комплементарных комплексов с другими участками матричной ДНК, что может привести к появлению неспецифических продуктов. Верхний предел температуры плавления ограничен оптимумом температуры действия полимеразы, активность которой падает при температурах выше 80 °C.
При выборе праймеров желательно придерживаться следующих критериев:
- GC-состав ~ 40—60 %;
- близкие Tm праймеров (отличия не более, чем на 5 °C);
- отсутствие неспецифических вторичных структур — шпилек[15] и димеров[16];
- желательно, чтобы на 3’-конце был гуанин или цитозин, поскольку они образуют три водородные связи с молекулой матрицы, делая гибридизацию более стабильной.
Амплификатор
ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно с точностью не менее 0,1 °C. Современные амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта», Touchdown ПЦР (см. ниже) и последующего хранения амплифицированных молекул при 4 °C. Для ПЦР в реальном времени выпускают приборы, оборудованные флуоресцентным детектором. Существуют также приборы с автоматической крышкой и отделением для микропланшет, что позволяет встраивать их в автоматизированные системы.
Ход реакции
Обычно при проведении ПЦР выполняется 20—35 циклов, каждый из которых состоит из трёх стадий.[≡]
Денатурация
Двуцепочечную ДНК-матрицу нагревают до 94—96 °C (или до 98 °C, если используется особенно термостабильная полимераза) на 0,5—2 минуты[источник не указан 793 дня], чтобы цепи ДНК разошлись. Эта стадия называется плавлением (денатурацией), так как разрушаются водородные связи между двумя цепями ДНК. Обычно перед первым циклом проводят длительный прогрев реакционной смеси в течение 2—5 минут для полной денатурации матрицы и праймеров.
Отжиг
Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Эта стадия называется отжигом. Температура отжига зависит от состава праймеров и обычно выбирается на 5 градусов меньше, чем температура плавления праймеров. Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифических продуктов (при заниженной температуре). Время стадии отжига — 30 секунд[источник не указан 793 дня], одновременно, за это время полимераза уже успевает синтезировать несколько сотен нуклеотидов. Поэтому рекомендуется подбирать праймеры с температурой плавления выше 60 °C и проводить отжиг и элонгацию одновременно, при 60—72 °C.
Элонгация
ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки. Это — стадия элонгации. Полимераза начинает синтез второй цепи от 3'-конца праймера, который связался с матрицей, и движется вдоль матрицы, синтезируя новую цепь в направлении от 5'- к 3'-концу. Температура элонгации зависит от полимеразы. Часто используемые полимеразы Taq и Pfu наиболее активны при 72 °C. Время элонгации зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 7—10 минут.[источник не указан 793 дня]
Количество специфического продукта реакции (ограниченного праймерами) теоретически возрастает пропорционально 2n — 2n, где n — число циклов реакции[17]. На самом деле эффективность каждого цикла может быть меньше 100 %, поэтому в действительности P ~ (1+E)n, где P — количество продукта, Е — средняя эффективность цикла.
Число «длинных» копий ДНК тоже растёт, но линейно, поэтому в продуктах реакции доминирует специфический фрагмент.
Рост требуемого продукта в геометрической прогрессии ограничен количеством реагентов, присутствием ингибиторов, образованием побочных продуктов. На последних циклах реакции рост замедляется, это называют «эффектом плато».
Варианты ПЦР
- RPA (Recombinase Polymerase Amplification — рекомбиназная полимеразная амплификация) — применяется там, где амплификация ДНК / РНК необходима в течение 15 минут без термоциклера (изотермальная реакция)[18][19].
- Вложенная ПЦР (nested PCR) — применяется для уменьшения числа побочных продуктов реакции. Используют две пары праймеров и проводят две последовательные реакции. Вторая пара праймеров амплифицирует участок ДНК внутри продукта первой реакции.
- Инвертированная ПЦР (inverse PCR) — используется в том случае, если известен лишь небольшой участок внутри нужной последовательности. Этот метод особенно полезен, когда нужно определить соседние последовательности после вставки ДНК в геном. Для осуществления инвертированной ПЦР проводят ряд разрезаний ДНК рестриктазами с последующим соединением фрагментов (лигирование). В результате известные фрагменты оказываются на обоих концах неизвестного участка, после чего можно проводить ПЦР как обычно.
- ПЦР с обратной транскрипцией (Reverse Transcription PCR, RT-PCR) — используется для амплификации, выделения или идентификации известной последовательности из библиотеки РНК. Перед обычной ПЦР проводят на матрице мРНК синтез одноцепочечной молекулы ДНК с помощью ревертазы и получают одноцепочечную кДНК, которая используется в качестве матрицы для ПЦР. Этим методом часто определяют, где и когда экспрессируются данные гены.
- Асимметричная ПЦР (asymmetric PCR) — проводится тогда, когда нужно амплифицировать преимущественно одну из цепей исходной ДНК. Используется в некоторых методиках секвенирования и гибридизационного анализа. ПЦР проводится как обычно, за исключением того, что один из праймеров берётся в большом избытке. Модификаций этого метода является Linear-After-The-Exponential-PCR (LATE-PCR), в котором используются праймеры с разной концентрацией, и праймер с низкой концентрацией подбирается с высокой (температурой плавления), чем праймер с высокой концентрацией. ПЦР проводят при высокой температуре отжига, тем самым удаётся поддержать эффективности реакции на протяжении всех циклов[20].
- Количественная ПЦР (quantitative PCR, Q-PCR), или ПЦР в реальном времени (real-time polymerase chain reaction), — используется для непосредственного наблюдения за измерением количества конкретного ПЦР продукта в каждом цикле реакции. В этом методе используют флуоресцентно меченые ДНК-зонды для анализа накопления продукта реакции или интеркалирующий краситель SYBR Green (или его аналоги). Sybr Green I обеспечивает простой и экономичный вариант для детекции и количественного определения ПЦР-продуктов в ходе ПЦР в режиме реального времени без необходимости использования специфичных флуоресцентных зондов или праймеров. В ходе амплификации краситель SYBR Green I встраивается в малую бороздку ДНК продуктов ПЦР и испускает более сильный по сравнению с несвязанным красителем флуоресцентный сигнал при облучении синим лазером. SYBR Green I совместим со всеми известными на сегодняшний день приборами для проведения ПЦР в режиме реального времени. Максимум поглощения для SYBR Green I находится при длине волны 494 нм. Кроме главного, в спектре красителя имеются два небольших дополнительных максимума поглощения — при 290 нм и 380 нм. Максимум испускания для SYBR Green I находится при длине волны 521 нм (зелёный)[21].
- Ступенчатая ПЦР (touchdown PCR) — с помощью этого подхода уменьшают влияние неспецифического связывания праймеров. Первые циклы проводят при температуре выше оптимальной температуры отжига, затем каждые несколько циклов температуру отжига постепенно снижают до оптимальной. Это делается для того, чтобы праймер гибридизовался с комплементарной цепью всей своей длиной; тогда как при оптимальной температуре отжига, праймер частично гибридизуется с комплементарной цепью. Частичная гибридизация праймера на геномной ДНК приводит к неспецифической амплификации, если участков связывания для праймера достаточно много. В большинстве случаев первые десять циклов ПЦР можно проводить при температуре отжига в 72-75 °С, а затем сразу снизить до оптимальной, например до 60-65 °С.
- Метод молекулярных колоний (ПЦР в геле, colony PCR) — акриламидный гель полимеризуют со всеми компонентами ПЦР на поверхности и проводят ПЦР. В точках, содержащих анализируемую ДНК, происходит амплификация с образованием молекулярных колоний.
- ПЦР с быстрой амплификацией концов кДНК (rapid amplification of cDNA ends, RACE-PCR).
- ПЦР длинных фрагментов (long-range PCR) — модификация ПЦР для амплификации протяжённых участков ДНК (10 тысяч и более оснований). Используют смесь двух полимераз, одна из которых — Taq-полимераза с высокой процессивностью (то есть способная за один проход синтезировать длинную цепь ДНК), а вторая — ДНК-полимераза с 3'-5'-экзонуклеазной активностью, обычно это полимераза Pfu. Вторая полимераза необходима для коррекции ошибок, внесённых первой, так как Taq-полимераза останавливает синтез ДНК, если был добавлен некомплементарный нуклеотид. Этот некомплементарный нуклеотид удаляет Pfu-полимераза. Смесь полимераз берётся в отношении 50:1 или даже меньше 100:1, где Taq-полимеразы берётся в 25—100 раз больше, чем Pfu-полимеразы.
- RAPD (Random Amplification of Polymorphic DNA), ПЦР со случайной амплификацией полиморфной ДНК — используется тогда, когда нужно различить близкие по генетической последовательности организмы, например, разные сорта культурных растений, породы собак или близкородственные микроорганизмы. В этом методе обычно используют один праймер небольшого размера (около 10 п.н.). Этот праймер будет частично комплементарен случайным участкам ДНК исследуемых организмов. Подбирая условия (длину праймера, его состав, температуру и пр.), удаётся добиться удовлетворительного отличия картины ПЦР для двух организмов.
- Групп-специфическая ПЦР (group-specific PCR) — ПЦР для родственных последовательностей внутри одного или между разными видами с использованием консервативных праймеров к этим последовательностям. Например, подбор универсальных праймеров к рибосомальным генам 18S и 26S для амплификации видоспецифического межгенного спейсера: последовательность генов 18S и 26S консервативна между видами, поэтому ПЦР между этими генами будет проходить для всех исследуемых видов. Противоположностью этому методу является уникальная ПЦР (unique PCR), где задача состоит в подборе праймеров для амплификации только одной последовательности изо всех родственных.
- ПЦР с использованием горячего старта (hot start PCR) — модификация ПЦР с использованием ДНК-полимеразы, в которой полимеразная активность блокируется при комнатной температуре антителами или имитирующими антитела небольшими молекулами типа Affibody, то есть в момент постановки реакции до первой денатурации в ПЦР. Обычно первая денатурация проводится при 95 °C в течение 10 минут.
- Виртуальная ПЦР (in silico PCR, электронная ПЦР, е-ПЦР) — математический метод компьютерного анализа теоретической полимеразной цепной реакции c использованием списка последовательностей праймеров (или ДНК-зондов) для предсказания потенциальной амплификации ДНК исследуемого генома, хромосомы, кольцевой ДНК или любого другого участка ДНК.
Если нуклеотидная последовательность матрицы известна частично или неизвестна вовсе, можно использовать вырожденные праймеры, последовательность которых содержит вырожденные позиции, в которых могут располагаться любые основания. Например, последовательность праймера может быть такой: …ATH…, где Н — А, Т или С.

Применение ПЦР
ПЦР используется во многих областях для проведения анализов и в научных экспериментах.
Криминалистика
ПЦР используют для сравнения так называемых «генетических отпечатков пальцев». Необходим образец генетического материала с места преступления — кровь, слюна, сперма, волосы и т. п. Его сравнивают с генетическим материалом подозреваемого. Достаточно совсем малого количества ДНК, теоретически — одной копии. ДНК расщепляют на фрагменты, затем амплифицируют с помощью ПЦР. Фрагменты разделяют с помощью электрофореза ДНК. Полученную картину расположения полос ДНК и называют генетическим отпечатком пальцев (genetic fingerprint).
Установление отцовства
Хотя «генетические отпечатки пальцев» уникальны, родственные связи всё же можно установить, сделав несколько таких отпечатков.[≡] Тот же метод можно применить, слегка модифицировав его, для установления эволюционного родства среди организмов.
Медицинская диагностика
ПЦР даёт возможность существенно ускорить и облегчить диагностику наследственных и вирусных заболеваний. Нужный ген амплифицируют с помощью ПЦР с использованием соответствующих праймеров, а затем секвенируют для определения мутаций. Вирусные инфекции можно обнаруживать сразу после заражения, за недели или месяцы (в зависимости от величины инкубационного периода) до того, как проявятся симптомы заболевания.
Персонализированная медицина
Иногда лекарства оказываются токсичными или аллергенными для некоторых пациентов. Причины этого — отчасти в индивидуальных различиях в восприимчивости и метаболизме лекарств и их производных. Эти различия детерминируются на генетическом уровне. Например, у одного пациента определённый цитохром (белок печени, отвечающий за метаболизм чужеродных веществ) может быть более активен, у другого — менее активен. Для того, чтобы определить, какой разновидностью цитохрома обладает данный пациент, предложено проводить ПЦР-анализ перед применением лекарства.[источник не указан 5274 дня] Такой анализ называют предварительным генотипированием (prospective genotyping).
Клонирование генов
Клонирование генов (не путать с клонированием организмов) — это процесс выделения генов и, в результате генноинженерных манипуляций, получения большого количества продукта данного гена. ПЦР используется для того, чтобы амплифицировать ген, который затем вставляется в вектор — фрагмент ДНК, переносящий чужеродный ген в тот же самый или другой, удобный для выращивания, организм. В качестве векторов используют, например, плазмиды или вирусную ДНК. Вставку генов в чужеродный организм обычно используют для получения продукта этого гена — РНК или, чаще всего, белка. Таким образом в промышленных количествах получают многие белки для использования в сельском хозяйстве, медицине и др.
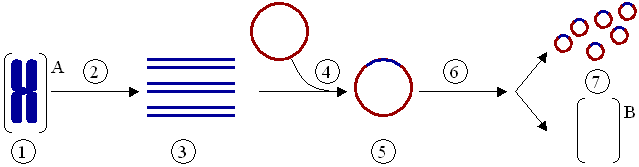
(1) Хромосомная ДНК организма A. (2) ПЦР. (3) Множество копий гена организма А. (4) Вставка гена в плазмиду. (5) Плазмида с геном организма А. (6) Введение плазмиды в организм В. (7) Умножение количества копий гена организма А в организме В
Секвенирование ДНК
В методе секвенирования с использованием меченных флуоресцентной меткой или радиоактивным изотопом дидезоксинуклеотидов ПЦР является неотъемлемой частью, так как именно в ходе полимеризации в цепь ДНК встраиваются производные нуклеотидов, меченные флуоресцентной или радиоактивной меткой. Присоединение дидезоксинуклеотида к синтезируемой цепи приводит к обрыву синтеза, позволяя определить положение специфических нуклеотидов после разделения в геле.
Мутагенез
В настоящее время ПЦР стала основным методом проведения мутагенеза (внесения изменений в нуклеотидную последовательность ДНК). Использование ПЦР позволило упростить и ускорить процедуру проведения мутагенеза, а также сделать её более надёжной и воспроизводимой.
Молекулярное сексирование
Ещё одной областью практического применения ПЦР является молекулярное сексирование — определение пола на основе половых различий на уровне ДНК между представителями мужского и женского полов[22].
См. также
Примечания
- ↑ Kleppe, K. et al. (1971): Studies on polynucleotides. XCVI. Repair replications of short synthetic DNA’s as catalyzed by DNA polymerases. In: J. Mol. Biol. Bd. 56, S. 341—361. PMID 4927950
- ↑ Bartlett, J. M. S.; Stirling, D. A Short History of the Polymerase Chain Reaction // PCR Protocols (неопр.). — 2nd. — 2003. — Т. 226. — С. 3—6. — (Methods in Molecular Biology). — ISBN 1-59259-384-4. — doi:10.1385/1-59259-384-4:3.
- ↑ Mullis, Kary B. et al. «Process for amplifying, detecting, and/or-cloning nucleic acid sequences» U.S. Patent 4 683 195
- ↑ Saiki R.K., Scharf S., Faloona F., Mullis K.B., Horn G.T., Erlich H.A., Arnheim N. Science 1985 Dec 20; 230 (4732): 1350-4; Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia.
- ↑ [Нобелевские лауреаты по химии, 1993 г. (англ.). Дата обращения: 29 августа 2007. Архивировано 26 октября 2012 года. Нобелевские лауреаты по химии, 1993 г. (англ.)]
- ↑ R. K. Saiki, D. H. Gelfand, S. Stoffel, S. J. Scharf, R. Higuchi, G. T. Horn, K. B. Mullis, H. A. Erlich. Primer-Directed Enzymatic Amplification of DNA with a Thermostable DNA Polymerase Архивная копия от 19 декабря 2008 на Wayback Machine. in: Science. 239.1988, 487—491. ISSN 0036-8075 PMID 2448875
- ↑ Каледин А. С., Слюсаренко А. Г., Городецкий С. И. // Биохимия. — 1980. — T. 45. — C. 644—651.
- ↑ Alice Chien, David B. Edgar и John M. Trela. Deoxyribonucleic Acid Polymerase from Extreme Thermophilic Thermus aquaticus. Jourmal of Bacteriology, Sept. 1976, pp. 1550—1557.
- ↑ Roche announces settlement agreement with Promega (недоступная ссылка). Дата обращения: 29 августа 2007. Архивировано 6 октября 2008 года.
- ↑ 1 kbp (англ. kilo base pair) — 1 тысяча пар оснований, единица измерения длины ДНК
- ↑ Venter J, et al. (2001). The sequence of the human genome. Science 291 (5507): 1304-51. PMID 11181995
- ↑ {title} (недоступная ссылка). Дата обращения: 1 сентября 2007. Архивировано 29 сентября 2007 года.
- ↑ Отжиг (annealing) — гибридизация фрагментов ДНК
- ↑ Nicolas von Ahsen, Carl T. Wittwer, Ekkehard Schütz. Oligonucleotide melting temperatures under pcr conditions: nearest-neighbor corrections for Mg2+, deoxynucleotide triphosphate, and dimethyl sulfoxide concentrations with comparison to alternative empirical formulas (англ.) // Clinical Chemistry : journal. — 2001. — Vol. 47, no. 11. — P. 1956—1961. Архивировано 1 сентября 2012 года.
- ↑ Шпилька — внутримолекулярная самокомплементарная структура
- ↑ Димер — межмолекулярные структуры, образуемые праймерами друг с другом или сами с собой
- ↑ Календарь Р. Н., Сиволап Ю. М. Полимеразная цепная реакция с произвольными праймерами // Биополимеры и клетка : журнал. — 1995. — Т. 11, № 3—4. — С. 55—65. — ISSN 0233-7657.
- ↑ Recombinase Polymerase Amplification (RPA) — the isothermal DNA/RNA amplification that really works.. Дата обращения: 9 сентября 2017. Архивировано 9 сентября 2017 года.
- ↑ Видео на англ.: What is Recombinase Polymerase Amplification? — TwistDx Архивная копия от 24 ноября 2016 на Wayback Machine
- ↑ Pierce KE and Wangh L. J. Linear-after-the-exponential polymerase chain reaction and allied technologies Real-time detection strategies for rapid, reliable diagnosis from single cells (англ.) // Methods Mol Med. : journal. — 2007. — Vol. Methods in Molecular Medicine™. — P. 65—85. — ISBN 978-1-58829-578-1. — doi:10.1007/978-1-59745-298-4_7. — PMID 17876077.
- ↑ Fluorescence SpectraViewer Fluorescence SpectraViewer | Life Technologies. Дата обращения: 30 октября 2012. Архивировано 15 ноября 2012 года.
- ↑ Romanov M. N., Ellegren H., Dodgson J. B. Polymerase chain reaction amplified markers for bird sexing // (International Plant and Animal Genome IX Conference (San Diego, 13—17 January 2001)). — San Diego, CA, USA: Scherago International. — P. 118. (англ.)
Литература
- Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер. с англ. — М.: Мир, 2002. — 589 с., илл. — ISBN 5-03-003328-9
- Патрушев Л. И. Искусственные генетические системы. — М.: Наука, 2005. — В 2 т. — ISBN 5-02-033278-X
- Щелкунов С. Н. Генетическая инженерия. — Новосибирск: Сиб. унив. издательство, 2004. — 496 с.; илл. — ISBN 5-94087-098-8
- Ahsen N, Wittwer CT, Schutz E 2001. Oligonucleotide Melting Temperatures under PCR Conditions: Nearest-Neighbor Corrections for Mg2+, Deoxynucleotide Triphosphate, and Dimethyl Sulfoxide Concentrations with Comparison to Alternative Empirical Formulas Архивная копия от 2 сентября 2011 на Wayback Machine. Clin Chem, 47:1956-1961.
- Kalendar R, Lee D, Schulman AH 2011. Java web tools for PCR, in silico PCR, and oligonucleotide assembly and analysis. Genomics, 98(2): 137—144. http://primerdigital.com/tools/ Архивировано 16 сентября 2012 года.
Ссылки
- Деятельность ПЦР-лаборатории. Организация работы при исследованиях методом ПЦР материала, инфицированного микроорганизмами I—II групп патогенности Архивная копия от 29 сентября 2010 на Wayback Machine.
- Сайт "Классическая и молекулярная биология": Методики, относящиеся к ПЦР Архивная копия от 8 июня 2007 на Wayback Machine


