Нитронафталины
Нитронафталины — органические соединения, нитропроизводные нафталина с общей формулой C10H8−n(NO2)n[1].
Изомерия

- Мононитронафталин имеет два изомера по положению нитрогруппы.
- Динитронафталин имеет 10 изомеров по положению заместителей[2]. Все десять изомеров синтезированы и описаны[3].
- Тринитронафталин имеет 14 изомеров[2].
- Тетранитронафталин имеет 22 изомера[2].
Химические свойства
- При хлорировании и бромировании мононитронафталинов галоид вступает в незамещенное кольцо по α-положению. Параллельно идёт реакция замещения нитрогруппы[источник не указан 3775 дней].
- При сульфировании α-нитронафталина олеумом образуется 5-нитронафталин-1-сульфокислота[4]. β-Нитронафталин при этом образует смесь 6- и 7-нитронафталин-1-сульфокислот.
Нитрование нафталина и нитронафталинов
Нитрование нафталина при умеренных[каких?] температурах приводит к образованию 1-нитронафталина (95 %) и 2-нитронафталина (5 %)[5]. Впервые это осуществил Лоран (англ. Laurent I.) в 1835 году[6].
2-Нитронафталин получают нитрованием гексахлорпентадиенового аддукта (1 молекула нафталина и 2 молекулы гексахлорпентадиена), при этом образуется исключительно β-нитронафталин[4]. Также 2-нитронафталин можно получить осторожным окислением β-нафтиламина кислотой Каро.
При нитровании α-нитронафталина или непосредственно нафталина получается смесь 1,5- и 1,8-изомеров (с преобладанием последнего)[6]. При нитровании β-нитронафталина образуется смесь 1,6- и 1,7-изомеров, а также 1,3,8-тринитронафталин[3]. Остальные динитронафталины получают не нитрованием мононафталинов, а другими[какими?] способами[7].
При дальнейшем нитровании динафталинов получают некоторые тринитронафталины, например 1,3,5-тринитронафталин, 1,3,6-тринитронафталин, 1,3,8-тринитронафталин и 1,4,5-тринитронафталин[8]. Аналогично некоторые тетранитронафталины получаются при дополнительном нитровании динитронафталинов или тринафталинов, например 1,3,5,7-тетранитронафталин, 1,3,5,8-тетранитронафталин, 1,3,6,8-тетранитронафталин, 1,4,5,8-тетранитронафталин[8][9].
Физические свойства
В разделе не хватает ссылок на источники (см. также рекомендации по поиску). |
| Изомер | Формула | Состояние | Т плав.°С | Т кип.°С | Растворимость | М.м., г/моль |
|---|---|---|---|---|---|---|
| 1-нитронафталин (α-нитронафталин) |
 |
светло-жёлтые иглы без запаха |
52[~ 1][10]; 57,8[10] |
304[10]; 169[~ 2][10] |
Орг. р-рители; ацетон: 131,6 18°С и 327,6 32°С | 173,18 |
| 2-нитронафталин (β-нитронафталин) |
бесцветные ромбические иглы |
78,7[10] | 312,5[~ 3][10] 165[~ 4][10] |
Легко растворим в этаноле и эфире | ||
| 1,2-динитронафталин |  |
161—162[10] | 218,17 | |||
| 1,3-динитронафталин |  |
жёлтые иглы | 148[10] | возг. | растворяется в этаноле | |
| 1,4-динитронафталин | 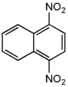 |
134[10] | растворяется в этаноле | |||
| 1,5-динитронафталин | 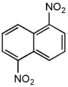 |
гексагональные иглы | 219[10] | пиридин: 0,78 16°С; 2,8 50°С; 10 110°С; | ||
| 1,6-динитронафталин |  |
166,5[10] | 370[10]; 235[~ 5][10] |
Растворим в горячем пиридине | ||
| 1,7-динитронафталин |  |
156[10] | ||||
| 2,3-динитронафталин |  |
174,5-175[10] | ||||
| 2,6-динитронафталин | 279[10] | |||||
| 2,7-динитронафталин | 234[10] | |||||
| 1,8-динитронафталин |  |
жёлтые ромбические иглы |
172[10] | слабо растворим в этаноле и бензоле | ||
| 1,2,3-тринитронафталин | 190[10] | 263,17 | ||||
| 1,2,4-тринитронафталин | 258[10] | |||||
| 1,2,5-тринитронафталин | бесцветные иглы | 112-113 | растворим в этаноле | |||
| 1,3,5-тринитронафталин | жёлтые ромбы | 122[10] | ||||
| 1,3,6-тринитронафталин | 186[10] | |||||
| 1,3,8-тринитронафталин | 218[10] | трудно растворим | ||||
| 1,4,5-тринитронафталин | жёлтые пластины | 149[10] | ||||
| 1,2,5,8-тетранитронафталин | призмы | 270 разл. | 308,17 | |||
| 1,2,4,6-тетранитронафталин | 215 | |||||
| 1,2,6,8-тетранитронафталин | 138 | |||||
| 1,3,5,7-тетранитронафталин | 260[10] | |||||
| 1,3,5,8-тетранитронафталин | жёлтые кристаллы | 194-195[10] | ||||
| 1,3,6,8-тетранитронафталин | иглы | 203[10] | ||||
| 1,4,5,8-тетранитронафталин | 340-345[~ 6][10] |
Применение
- 1-Нитронафталин важен как предшественник в синтезе сернистого коричневого и других красителей, нафтиламина, 1,8-нафтилендиамина, капрозолей. Его также применяют как добавку к минеральным маслам[1].
- Нитронафталины входят в состав различных взрывчатых веществ (составы Фавье) и порохов[источник не указан 3775 дней].
Токсичность
- 1-Нитронафталин оказывает раздражающее действие на кожу, вызывает слезотечение. Имеет гепатотоксичность и нефротоксичность. ПДК 1 мг/м³[1][5].
- Тринитронафталины вызывают значительное раздражение глаз и слизистых оболочек. Симптомы отравления — цианоз, анемия, желтуха, общая слабость, раздражение дыхательных путей[источник не указан 3775 дней].
- Описано раздражение слизистой глаз с помутнением роговицы и ослаблением зрения у работающих[источник не указан 3775 дней].
Комментарии
Примечания
- ↑ 1,0 1,1 1,2 Нитронафталины // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др. — М.: Советская энциклопедия, 1992. — Т. 3. — С. 278. — 639 с. — ISBN 5-82270-039-8.
- ↑ 2,0 2,1 2,2 Дональдсон, 1963, с. 13.
- ↑ 3,0 3,1 Дональдсон, 1963, с. 199.
- ↑ 4,0 4,1 Дональдсон, 1963, с. 198.
- ↑ 5,0 5,1 Booth, G. Nitro compaunds, aromatic. Nitronaphthalenes // Ullmann's Encyclopedia of Industrial Chemistry. — 2000. — С. 14-16. — ISBN 978-3-527-30673-2.
- ↑ 6,0 6,1 Дональдсон, 1963, с. 195.
- ↑ Дональдсон, 1963, с. 201-205.
- ↑ 8,0 8,1 Дональдсон, 1963, с. 200.
- ↑ Дональдсон, 1963, с. 206.
- ↑ 10,00 10,01 10,02 10,03 10,04 10,05 10,06 10,07 10,08 10,09 10,10 10,11 10,12 10,13 10,14 10,15 10,16 10,17 10,18 10,19 10,20 10,21 10,22 10,23 10,24 10,25 10,26 10,27 10,28 Van Nostrand's encyclopedia of chemistry / Glenn D. Considine. — 5th ed.. — Wiley-interscience, 2005. — С. 1049-1050. — 1831 с. — ISBN 0-471-61525-0.
Литература
- Справочник химика / Редкол.: Никольский Б. П. и др. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Tadeusz Urbanski. Chemistry and Technology of Explosives. — Oxford — London. New York — Paris.: Pergamon Press, 1964. — Т. I. — 635 с.
- Дональдсон Н. Химия и технология соединений нафталинового ряда. — М.: Госхимиздат, 1963. — 656 с.
- Общая органическая химия / Под ред. Бартон Д. — М.: «Химия», 1982. — Т. 3. — 738 с.