Дихромат аммония
| Дихромат аммония | |
|---|---|
  | |
 | |
| Общие | |
| Систематическое наименование |
Дихромат аммония |
| Традиционные названия | Аммоний двухромовокислый, бихромат аммония |
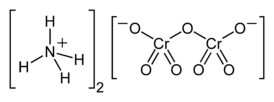
| Рац. формула | (NH4)2Cr2O7 |
| Физические свойства | |
| Молярная масса | 252,07 г/моль |
| Плотность | 2,115 г/см³ |
| Термические свойства | |
| Мол. теплоёмк. | 293 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1810 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 35,620; 115100; |
| Классификация | |
| Рег. номер CAS | 7789-09-5 |
| SMILES | |
| RTECS | HX7650000 |
| Безопасность | |
| Предельная концентрация | 10 мкг/м3 воздуха[1] |
| ЛД50 | 20 мг/кг[2] |
| Токсичность | токсин, канцероген, аллерген, мутаген; сильнейший окислитель |
| Фразы риска (R) | R45, R46, R60, R61, R2, R8, R21, R25, R26, R34, R42/43, R48/23, R50/53 |
| Фразы безопасности (S) | S53, S45, S60, S61 |
| Краткие характер. опасности (H) | 272, 301, 312, 314, 317, 330, 334, 340, 350, 360, 372, 410[3] |
| Меры предостор. (P) | 201, 220, 260, 273, 280, 284[3] |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дихромат аммония — неорганическое химическое вещество, соль аммония и дихромовой кислоты с формулой (NH4)2Cr2O7, кристаллическое вещество оранжево-красного цвета, хорошо растворимое в воде.
Получение
Дихромат аммония получают взаимодействием оксида хрома(VI) с разбавленным раствором аммиака:
- [math]\displaystyle{ \mathsf{2CrO_3 + 2(NH_3\cdot H_2O) \ \xrightarrow{\ }\ (NH_4)_2Cr_2O_7 + H_2O } }[/math]
Физические свойства
Оранжево-красные кристаллы принадлежат к моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 1,327 нм, b = 0,754 нм, c = 0,778 нм, β = 93,70°, Z = 4.
Плотность 2,15 г/см³. Растворяется в воде и этаноле, не растворяется в ацетоне.
Химические свойства
- В водных растворах дихромат аммония подвергается гидролизу (по катиону) и незначительной гидратации аниона:
- [math]\displaystyle{ \mathsf{NH_4^+ + H_2O \ \rightleftarrows\ NH_3\cdot H_2O + H^+ } }[/math]
- [math]\displaystyle{ \mathsf{Cr_2O_7^{2-} + H_2O \ \rightleftarrows\ 2\ HCrO_4^- \ \rightleftarrows\ 2\ CrO_4^{2-} + H^+ } }[/math]
- Очень зрелищная самоподдерживаемая экзотермическая реакция разложения дихромата аммония — «вулкан Бёттгера»:
- [math]\displaystyle{ \mathsf{(NH_4)_2Cr_2O_7 \ \xrightarrow{\ }\ Cr_2O_3 + N_2\uparrow + 4\ H_2O } }[/math]
- Сухой дихромат аммония взаимодействует с концентрированными растворами галогеноводородов:
- [math]\displaystyle{ \mathsf{(NH_4)_2Cr_2O_7 + 14\ HCl\ \xrightarrow{\ }\ 2\ CrCl_3 + 3\ Cl_2\uparrow + 2\ NH_4Cl + 7\ H_2O } }[/math]
- Щёлочи переводят дихромат в хромат:
- [math]\displaystyle{ \mathsf{(NH_4)_2Cr_2O_7 + 2\ NaOH\ \xrightarrow{\ }\ Na_2CrO_4 + (NH_4)_2CrO_4 + H_2O } }[/math]
Применение
Применяются в металлообрабатывающей, кожевенной, текстильной, химической, лакокрасочной, фармацевтической, керамической, спичечной промышленности.
Опасность
Биологическая опасность
- См. также Chromium toxicity[англ.]

Как и многие другие соединения шестивалентного хрома[англ.], дихромат аммония является высокотоксичной (очень ядовитой), канцерогенной, аллергенной солью. Генотоксичен, мутаген.[4]. Вдыхание пыли приводит к онкологическим заболеваниям. Раздражает кожу и дыхательные пути, оказывает разъедающее действие на глаза. При попадании в ЖКТ или легкие всасывается в организм и может оказывать действие на почки и печень, приводя к поражению почек при длительном воздействии. Длительное вдыхание может вызвать астму. Смертельная доза (LD50) при попадании через ЖКТ для крыс составляет от 20 до 250 мг/кг живого веса.[2]
В России для всех солей дихромовой кислоты класс опасности 1 (чрезвычайно опасные вещества) согласно ГОСТ 12.1.007-76, максимальная разовая концентрация ПДК в воздухе рабочей зоны составляет 10 мкг/м3 (1998 год).[1] В США предельный пороговый уровень однократного воздействия составляет 50 мкг/м³ воздуха (ACGIH, 2000 год).[5] Средневзвешенная концентрация за 8-часовой рабочий день в воздухе не более 0,5 мкг/м3 (OSHA, 2006 год).[6] В ЕС все соединения шестивалентного хрома подпадают под директиву RoHS. Для питьевой воды и пищи ВОЗ рекомендует максимальное содержание шестивалентного хрома не более 50 мкг/кг.[2]
Вещество очень токсично для водных организмов, вызывает долговременные изменения в водной экосистеме. Накапливается[англ.] в живых организмах.
Вследствие чрезвычайно высокой токсичности солей шестивалентного хрома демонстрация зрелищного опыта «вулкан Бёттгера» запрещена в школах многих стран.[7]
Химическая опасность
При нагревании в герметичных контейнерах взрывоопасен.[8] В январе 1986 года двое рабочих погибли и 14 пострадали в США при взрыве 900 килограммов вещества во время сушки.[9]
Пожарная опасность
Горюч, самовоспламеняется при 225°С. Является окислителем, реагирует с горючими материалами, воспламеняя их.
Примечания
- ↑ 1,0 1,1 ПРЕДЕЛЬНО ДОПУСТИМЫЕ КОНЦЕНТРАЦИИ (ПДК) ВРЕДНЫХ ВЕЩЕСТВ В ВОЗДУХЕ РАБОЧЕЙ ЗОНЫ. Гигиенические нормативы. ГН 2.2.5.686-98. Дата обращения: 31 октября 2016. Архивировано 4 ноября 2016 года.
- ↑ 2,0 2,1 2,2 Chromium in Drinking-water. Дата обращения: 2 ноября 2016. Архивировано 30 ноября 2016 года.
- ↑ 3,0 3,1 Ammonium dichromate. Дата обращения: 28 марта 2022. Архивировано 28 марта 2022 года.
- ↑ Мамырбаев А. А. ТОКСИКОЛОГИЯ ХРОМА И ЕГО СОЕДИНЕНИЙ, 2012 (недоступная ссылка). Дата обращения: 31 октября 2016. Архивировано 31 октября 2017 года.
- ↑ АММОНИЙ ДИХРОМАТ
- ↑ Small Entity Compliance Guide for the Hexavalent Chromium Standards. Дата обращения: 2 ноября 2016. Архивировано 10 мая 2019 года.
- ↑ Unterricht in Schulen mit gefährlichen Stoffen, стр. 21. Дата обращения: 3 ноября 2016. Архивировано 30 ноября 2016 года.
- ↑ Young, A.J. CLIP, Chemical Laboratory Information Profile: Ammonium Dichromate (англ.) // J. Chem. Educ.[англ.] : journal. — 2005. — Vol. 82, no. 11. — P. 1617. — doi:10.1021/ed082p1617.
- ↑ Diamond, S. The New York Times, 1986, p. 22.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
